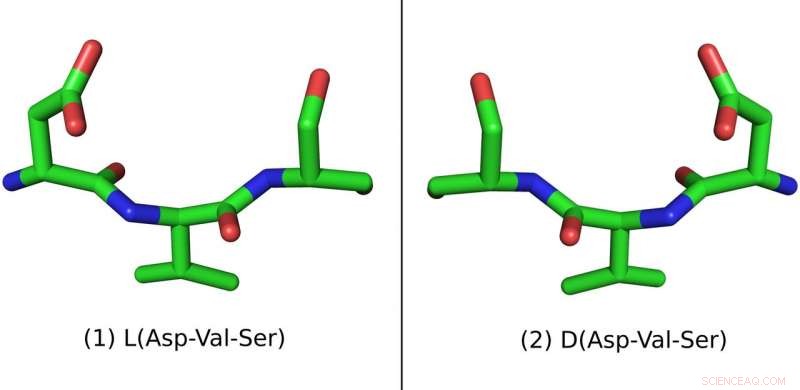
Ce peptide est constitué de trois acides aminés :Acide aspartique (Asp), Valine (Val) et Sérine (Ser). La forme en L naturelle est à gauche et la forme en D synthétique est à droite Crédit :Pablo Gainza
Des chercheurs de l'Université de Toronto ont mis au point une nouvelle technologie pour créer des molécules de lutte contre les maladies plus durables qui pourraient conduire à des médicaments ayant des effets plus durables.
La version miroir des médicaments existants durerait plus longtemps dans le corps grâce à leur capacité à éviter la dégradation par les enzymes de l'estomac et de la circulation sanguine. Pour les malades, cela signifierait des injections de médicaments moins fréquentes et davantage de médicaments pourraient être disponibles sous forme de pilules.
La conception de ces médicaments a été délicate, toutefois.
Désormais, une équipe de chercheurs dirigée par Philip Kim, professeur d'informatique et de génétique moléculaire au Donnelly Centre for Cellular and Biomolecular Research de l'Université de Toronto, a développé une nouvelle technologie pour fabriquer des peptides à image miroir, qui se lient et activent les récepteurs à la surface des cellules. Ils ont créé des versions miroir de médicaments à succès, le glycogène-like-peptide 1 (GLP1) et l'hormone parathyroïdienne (PTH). Le GLP1 est largement utilisé pour traiter le diabète, et la PTH est un traitement de l'hypoparathyroïdie, une condition dans laquelle le corps produit trop peu de PTH et affecte la fonction musculaire, et l'ostéoporose. Les deux homologues à image miroir ont eu des effets plus longs sur les cellules que les médicaments existants.
Les résultats sont décrits dans la première édition en ligne du 29 janvier du Actes de l'Académie nationale des sciences .
"Les peptides d'image miroir ne sont pas reconnus et dégradés par les enzymes de l'estomac ou de la circulation sanguine et ont donc un effet durable, " dit Kim. L'autre avantage, il a dit, est que les peptides à image miroir sont également négligés par le système immunitaire, qui confond souvent les peptides naturels avec des envahisseurs étrangers et limite ainsi l'efficacité du médicament.
Les peptides sont fabriqués à partir de molécules appelées acides aminés. Pour des raisons mal comprises et qui remontent à l'origine de la vie, presque tous les acides aminés dans le monde naturel se présentent sous une forme géométrique. Leurs atomes sont disposés de telle manière que toute la molécule d'acide aminé semble gaucher, ou "L" pour faire court. Par conséquent, les peptides naturels sont également gauchers. Parce que les peptides produits par les microbes, les plantes et les animaux peuvent être nocifs, le corps humain a développé des moyens efficaces pour les purger.
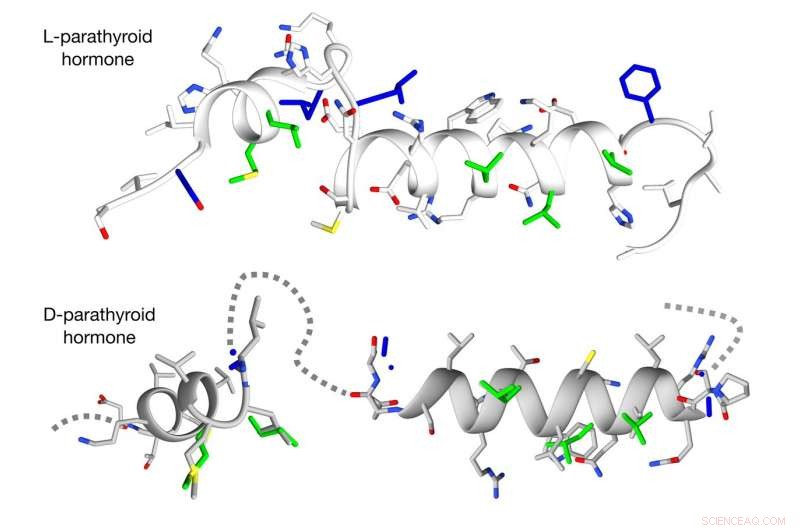
La nouvelle méthode surmonte les obstacles dans la conception de versions D de peptides hélicoïdaux complexes. Crédit :Michael Garton, Université de Toronto
Mais si vous inversez l'orientation géométrique d'un peptide, en en faisant une image miroir, il peut toujours se lier aux bons récepteurs tout en glissant inaperçu au-delà des mécanismes de défense du corps. Des peptides d'image miroir peuvent être fabriqués en laboratoire à partir d'acides aminés droitiers synthétiques, qui sont également connus comme "D" pour dextrogyre.
Contrairement aux peptides L simples, qui peut être assez facilement converti en une forme D, la plupart des peptides biologiquement actifs sont tordus en hélices, et jusqu'à présent, il n'y a pas eu de bon moyen de concevoir leurs homologues en miroir à grande échelle, dit Kim.
En utilisant une approche purement informatique, L'équipe de Kim a réussi à franchir cet obstacle. Ils ont commencé avec la plus grande base de données publique qui contient des informations structurelles pour trois millions de peptides hélicoïdaux. Ils ont ensuite créé un algorithme pour transformer ces peptides en leurs homologues D. Finalement, l'équipe a recherché dans cette nouvelle bibliothèque virtuelle de peptides d'image miroir ceux qui correspondaient le mieux à GLP1 et PTH.
Une fois qu'ils ont trouvé le match, les chercheurs ont synthétisé les D-peptides et testé leur capacité à activer leurs récepteurs à la surface de la cellule. Ils ont découvert que la D-GLP1 et la D-PTH provoquaient des réponses cellulaires similaires à leurs homologues naturelles, mais avaient un effet plus durable.
« Nous cherchons maintenant à savoir si la D-PTH pourrait être administrée par voie orale car elle évite la dégradation de l'estomac », dit Kim. "Pour les médicaments fréquemment dosés, c'est d'un grand intérêt, car prendre une pilule est beaucoup plus facile que d'avoir une injection. Cela pourrait conduire à la prise de beaucoup plus de médicaments peptidiques sous forme de pilules".
Actuellement, les patients qui prennent du GLP1, découvert à l'Université de Toronto par le professeur Daniel Drucker, du Département de médecine, ou PTH, doit s'injecter ces drogues quotidiennement.
Kim travaille avec le bureau des brevets de l'Université de Toronto pour protéger sa technologie alors qu'il explore des opportunités de partenariat avec l'industrie pharmaceutique pour commercialiser la recherche. Il développe également des versions en miroir de peptides qui agissent contre les virus de la Dengue et Zika afin de les rendre plus durables dans la circulation sanguine.
"Nous testons notre approche sur autant de peptides intéressants que possible, ", a déclaré Kim.