Figure :Une nouvelle transformation pour une synthèse efficace de molécules organiques complexes
Les chercheurs de l'Université de Nagoya ont découvert une nouvelle façon de modifier les réactifs qui ont été largement étudiés et utilisés depuis plus de 50 ans, permettant une production plus efficace de certaines molécules organiques complexes utilisées dans les médicaments. L'ouvrage a été publié en Communication Nature .
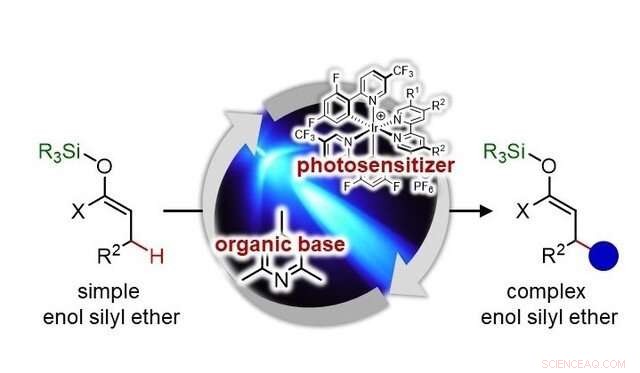
Les chimistes synthétiques utilisent souvent une classe de molécules appelées énol silyléthers, dans lequel l'atome de silicium (Si), atome d'oxygène (O), et l'atome de carbone (C) sont connectés comme Si-O-C=C (- est une simple liaison, et =est une double liaison). Ces molécules sont réactives pour former une nouvelle liaison au niveau de l'atome de carbone non attaché à l'atome d'oxygène, servant de substrats fiables pour une synthèse efficace et sélective de composés carbonylés fonctionnalisés, et a donc été largement utilisé en chimie organique de synthèse depuis plus de 50 ans.
Le professeur Takashi Ooi et ses collègues de l'Institut des biomolécules transformatrices de l'Université de Nagoya au Japon voulaient savoir si la formation sélective de liaisons C-C à une position intrinsèquement inerte des éthers énoliques silyliques pouvait être accomplie pour former des éthers énoliques silyliques plus complexes, qui sont ensuite disponibles pour d'autres transformations chimiques.
Ils ont développé une réaction chimique par l'utilisation combinée de deux catalyseurs, un photosensibilisateur et une base organique, sous irradiation de lumière visible (LED bleue). La nouvelle réaction n'élimine pas un groupe silyle, ce qui conduit normalement à la formation de composés carbonylés simples. Plutôt, il clive une liaison carbone-hydrogène relativement stable, ce qui permet le remplacement de l'hydrogène par un groupe alkyle. Le nouveau procédé permet aux chimistes de synthétiser des composés carbonylés complexes auparavant difficiles d'accès, et il peut accélérer la découverte de nouveaux médicaments.
Cette stratégie catalytique devrait également aider à rationaliser la synthèse d'une variété d'autres molécules organiques. "Notre stratégie ne se limite pas aux énol silyléthers, " dit Ooi. "Nous aimerions l'appliquer à d'autres composés organiques pour permettre des réactions de formation de liaisons à des positions auparavant difficiles à fonctionnaliser dans les molécules."
L'article, « Alkylation allylique directe en C-H des éthers d'énol silyle activée par catalyse hybride photoredox-base de Brønsted, " a été publié dans Communication Nature .