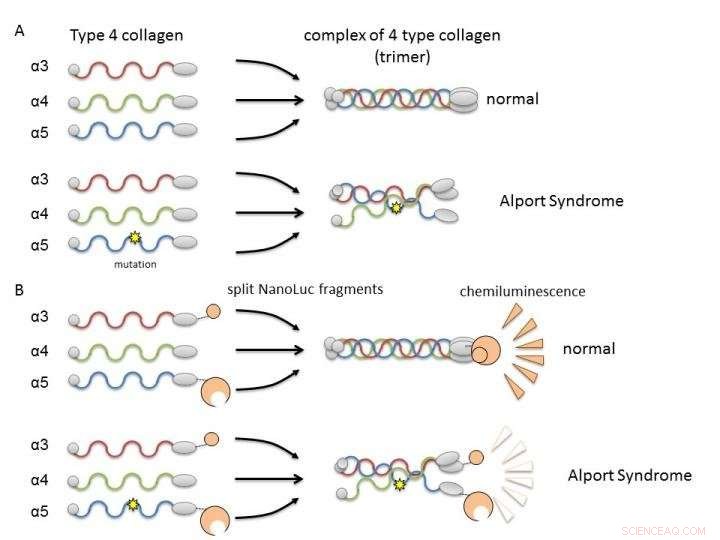
(A) Collagène IV alpha-3, alpha-4, et alpha-5 forment normalement des complexes (trimères) et deviennent des constituants de la membrane basale du rein. Dans le syndrome d'Alport, une mutation génétique dans l'une des chaînes perturbe la formation des trimères. (B) En fusionnant des chaînes de collagène à des fragments de nanoluciférase, il est possible d'évaluer la formation de trimères d'alpha-3, alpha-4, et alpha-5 par intensité de luminescence. Crédit :Dr Kohei Omachi
Le syndrome d'Alport (SA) est une maladie rénale héréditaire causée par une mutation génétique conduisant à des anomalies du collagène de type IV (Col4). Malheureusement, le traitement par la correction de la fonctionnalité Col4 n'a pas encore été développé. Maintenant, des chercheurs de l'Université de Kumamoto au Japon ont mis au point une technologie très sensible pour évaluer la fonctionnalité Col4, ouvrant la voie aux médicaments thérapeutiques. Ce système de détection réduit les coûts de main-d'œuvre et de temps par rapport aux méthodes conventionnelles, et surveille la fonctionnalité de Col4 avec une sensibilité plus élevée que jamais. Le système permet également d'analyser simultanément plusieurs composés candidats-médicaments.
Les inhibiteurs de l'ECA et d'autres médicaments pour le traitement de l'hypertension ralentissent la progression de la SA. Cependant, ce traitement ne fait que soulager les symptômes et ne peut empêcher le passage à l'insuffisance rénale terminale. Il est donc considéré que le traitement fondamental doit se concentrer sur la cause de l'apparition de la maladie, une approche complètement différente des méthodes antérieures. La stratégie thérapeutique, dans ce cas, se concentrerait sur la normalisation de la fonction de la protéine causale avec un composé médicamenteux candidat. En cas de succès, cette technique contribuerait grandement au traitement d'autres maladies héréditaires.
Pour normaliser la fonction de la protéine causale avec un composé médicamenteux candidat, il est nécessaire de cribler et d'identifier efficacement les composés qui restaurent la fonction compromise par la mutation génétique. Cependant, un système d'analyse pour évaluer la fonctionnalité des protéines responsables n'a pas encore été développé. Un tel système pourrait être utilisé pour cribler des candidats médicaments thérapeutiques. Ainsi, Les chercheurs de l'Université de Kumamoto visaient à établir un nouveau système d'évaluation (un système de criblage composé) juste à cette fin.
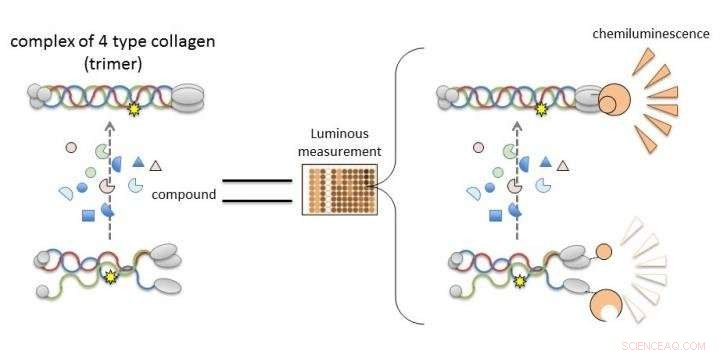
Collagène IV alpha-3, alpha-4, et l'alpha-5 dans le syndrome d'Alport ne peut pas former de trimères, donc la découverte de composés qui conduisent ou améliorent leur formation conduira au développement de nouvelles thérapies. De nouveaux travaux de l'Université de Kumamoto permettent d'évaluer la trimérisation des chaînes alpha du collagène IV en mesurant la luminescence. Les composés qui induisent la luminescence dans le système NanoLuc-Col4 sont susceptibles de favoriser la trimérisation. Crédit :Dr Kohei Omachi
En Col4, trois chaînes polypeptidiques (protéines en bâtonnets), alpha-3, alpha-4, et alpha-5, forment un complexe appelé trimère protéique. Ce trimère est un facteur constitutif de la membrane basale dans la partie du rein appelée glomérule. La membrane basale glomérulaire est une barrière physique contre les fuites de composants sanguins lors de la filtration du sang, une fonction rénale importante pour la production d'urine. Une mutation dans l'une quelconque des trois chaînes polypeptidiques peut perturber la formation du trimère et entraîner le développement de la SA en raison d'une incapacité à former correctement la membrane basale. Par conséquent, il est nécessaire de rechercher des composés capables de corriger ou d'aider à la formation de trimères par le collagène mutant.
Les chercheurs ont utilisé split NanoLuciferase (split NanoLuc, NanoBiT) pour l'analyse des interactions protéine-protéine comme méthode d'évaluation de la formation de trimère. Des fragments de deux grandes et petites molécules de luciférase ont été fusionnés avec des chaînes alpha-3 et alpha-5 et exprimés dans des cellules avec des chaînes alpha-4. La luminescence mesurable n'a été détectée que lorsque alpha-3, alpha-4, et les chaînes alpha-5 pourraient former des trimères.
Les chercheurs ont précisé que le système NanoLuc-Col4 reflète les caractéristiques précédemment signalées de Col4, à savoir que les trimères sont formés avec une combinaison fixe d'alpha-3, alpha-4, et chaînes alpha-5, et que les chaînes alpha-5 ne peuvent pas former des trimères s'il leur manque une partie fonctionnelle. Le système NanoLuc-Col4 a également révélé que les chaînes alpha-5 avec les mutations génétiques signalées dans la SA ne fonctionnaient pas. Surtout, comme preuve de principe que la correction de la formation de trimère pour le collagène mutant est faisable, les auteurs ont pu utiliser le système pour identifier des composés capables d'induire la formation de trimères d'alpha-3, collagène alpha-4 et alpha-5 mutant.
"Cette recherche devrait ouvrir la voie au développement de médicaments pour les maladies héréditaires, comme le syndrome d'Alport, qui sont actuellement incurables, " a déclaré le professeur Hirofumi Kai du Département de médecine moléculaire de l'Université de Kumamoto.
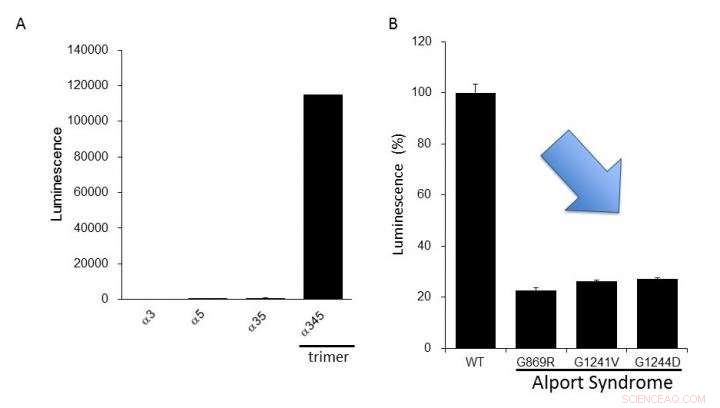
(A) Expression du collagène IV alpha-3, alpha-4, et alpha-5 dans les cellules. Une luminescence élevée n'a été produite que lors de la formation du trimère alpha-345. (B) Les protéines mutantes alpha-5 signalées dans le syndrome d'Alport avaient une formation de trimère inférieure à celle du type normal (WT). Cela suggère que nous pouvons évaluer les anomalies fonctionnelles du collagène IV trouvées dans le syndrome d'Alport en utilisant ce système de dosage. Crédit :Dr Kohei Omachi