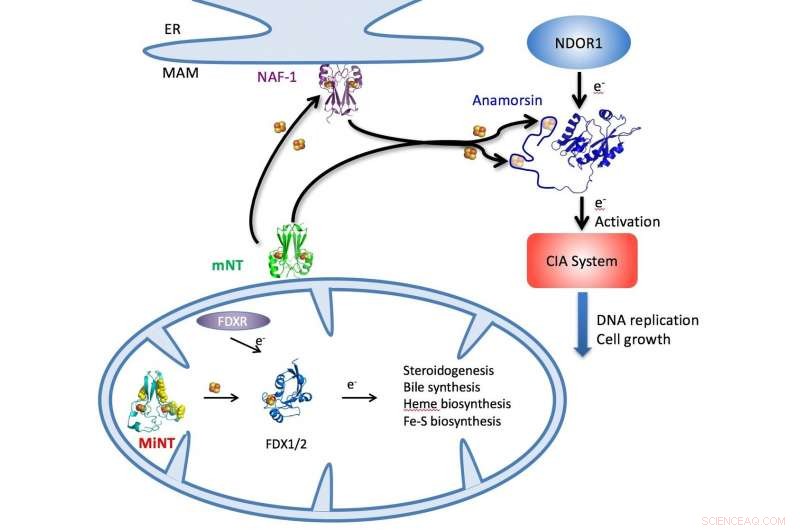
Une illustration décrit le cycle NEET dans les cellules par lequel les amas fer-soufre sont délivrés par MiNT, les protéines mitoNEET (mNT) et NAF-1 dans le cytosol ou les mitochondries (en bas) à un éventail de processus métaboliques cellulaires, y compris la synthèse d'ATP. Crédit :Patricia Jennings/Université de Californie à San Diego
Une protéine à double face dans une chaîne qui régule le fer et d'autres éléments dans les cellules pourrait fournir une nouvelle cible pour traiter le cancer, diabète et autres maladies.
Une équipe de chercheurs de l'Université Rice, l'Université de Californie à San Diego (UCSD), l'Université hébraïque de Jérusalem et l'Université du Texas du Nord ont détaillé la structure d'une protéine appelée NEET interne mitochondriale (MiNT), partie d'une voie qui stabilise les mitochondries, les organites qui produisent de l'énergie pour les cellules.
Leur rapport paraît cette semaine dans le Actes de l'Académie nationale des sciences .
MiNT est distinct de ses cousins, les protéines NEET mitoNEET et NAF-1, mais ils jouent tous un rôle dans la progression du cancer, Diabète, maladies neurodégénératives et vieillissement. Les protéines NEET ont été au centre des préoccupations de l'équipe qui a précédemment signalé leur importance dans la liaison des amas toxiques de fer et de soufre dans les cellules et comme cible possible pour traiter le cancer du sein.
Dans la nouvelle étude, les chercheurs dirigés par les collaborateurs de longue date Patricia Jennings à l'UCSD et José Onuchic au Rice's Center for Theoretical Biological Physics (CTBP) sont devenus les premiers à détailler la structure cristalline de MiNT, également connu sous le nom de CISD3, qui réside à l'intérieur des mitochondries.
Jennings et son équipe ont produit la structure moléculaire. Avec ça, ils ont pu montrer que si MiNT partage certaines caractéristiques avec d'autres protéines fer-soufre de la famille NEET, il existe des différences significatives qui en font probablement le plus puissant des trois.
MitoNEET et NAF-1 (alias CISD1 et CISD2, respectivement) sont des dimères, protéines avec deux similaires, monomères connectés qui résident dans le cytosol, le fluide à l'intérieur des cellules. Mais MiNT est un monomère qui vit exclusivement à l'intérieur des mitochondries, où il récupère les clusters fer-soufre livrés par les autres NEET et les distribue pour faciliter, entre autres, la synthèse d'adénosine triphosphate (ATP), la molécule qui transporte l'énergie à travers les cellules pour permettre les processus métaboliques.
MiNT diffère également en montrant deux côtés de son environnement, l'un hydrophobe (résistant à l'eau) et l'autre hydrophile (attirant l'eau). "Parce que c'est un monomère, chaque côté est différent, il va donc interagir avec différentes protéines, et vous pourrez peut-être le cibler avec des médicaments différents de chaque côté, " dit Jennings, affilié au CTBP et professeur de chimie et de biochimie à l'UCSD.
"C'est plus rapide et plus efficace que les autres NEET, " dit Onuchic, dont le laboratoire a construit des simulations informatiques pour étudier la dynamique de pliage de MiNT. « Il serait très dangereux d'avoir une protéine comme celle-là dans le cytosol;
c'est pourquoi il est restreint à l'intérieur des mitochondries, où se déroulent de nombreux processus bioénergétiques."
Les chercheurs ont déclaré que MiNT est essentiel à l'équilibre du fer et des espèces réactives de l'oxygène (ROS) dans les mitochondries. "Le fer est toxique, " a déclaré Jennings. " Trop de liquide dans la cellule est mauvais. Nous devons donc le contrôler dans notre corps car il est si important pour la régulation de l'énergie et la clé de la santé et de la maladie.
"Avec la structure de MiNT, nous pouvons commencer à comprendre la boucle de régulation complète qui contrôle les amas fer-soufre et les ROS qui n'étaient pas reconnus auparavant, " dit-elle. " Nous pouvons commencer à voir comment ces protéines régulent le flux entrant et sortant des mitochondries. "
Le rôle de MiNT dans la production d'ATP pourrait en faire une cible efficace pour le rétrécissement des tumeurs, dit Onuchic. Des expériences précédentes avec les autres NEET ont montré que la régulation négative de leur expression ou le ciblage de leurs centres réduisait la quantité d'énergie disponible pour les cellules cancéreuses, qui réduit la croissance tumorale.
"Les cellules cancéreuses ont besoin de beaucoup plus de fer que les cellules saines avec une homéostasie normale du fer, " dit-il. " Quand une cellule se divise, il doit doubler les ribosomes, et c'est énergétiquement très cher. Parce que les cellules cancéreuses se divisent si rapidement, ils ont besoin de beaucoup plus de fer et dépendent du cycle NEET pour en fournir.
"Le cancer utilise les trois protéines NEET car elles nécessitent beaucoup de fer et d'oxygène réactif, " a déclaré Onuchic. il rend les tumeurs plus petites. Même si vous n'en renversez qu'un seul, il réduit la croissance du cancer." Parce que MiNT est un producteur plus prodigieux de fer et de ROS, c'est peut-être le plus efficace des trois à cibler, il a dit.
"La découverte de la structure MiNT, la dynamique et l'implication dans l'accumulation du fer mitochondrial et des ROS ont permis de caractériser la famille complète des protéines humaines NEET, " a déclaré la co-auteur Rachel Nechushtai, professeur à l'Université hébraïque de Jérusalem. "De plus, il offre à notre équipe internationale l'opportunité unique de démêler les interrelations des trois protéines NEET et de découvrir dans quelles voies cellulaires elles sont impliquées.
"La découverte que les trois protéines fer-soufre coopèrent dans la même voie pour protéger les cellules cancéreuses fournit un excellent ensemble de cibles pour le traitement du cancer, " elle a dit.
"Le lien que les protéines NEET fournissent entre les niveaux de fer dans les cellules cancéreuses et le niveau d'espèces réactives de l'oxygène démontre comment les cellules cancéreuses contrôlent l'équilibre entre un taux élevé de prolifération et de mutations, qui est la clé de notre compréhension de la façon de lutter contre le cancer, " a déclaré le co-auteur Ron Mittler, professeur de sciences biologiques à l'Université de North Texas.