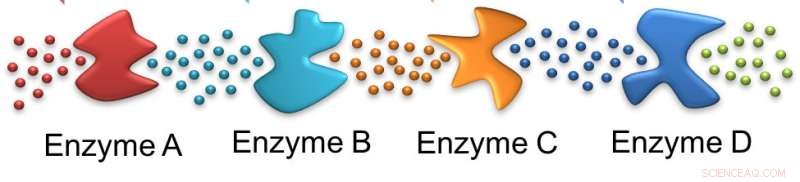
Comme des fourmis, une enzyme suit la piste laissée par la précédente. Dans ce cas, le substrat initial est sollicité par l'enzyme A, laissant un substrat approprié pour l'enzyme B et sur toute la ligne. Crédit :Ayusman Sen, État de Pennsylvanie
Une cuillerée de sucre peut faire baisser le médicament, mais comprendre ce qui arrive à ce sucre dans la cellule est bien plus compliqué que la simple digestion, selon les chercheurs. Pour que les sucres métabolisent et fournissent de l'énergie aux cellules, une série d'enzymes - catalyseurs biologiques - doivent chacun, à son tour, décomposer un réactif. Dans ce cas, les chercheurs ont utilisé du glucose, le sucre présent dans le sirop de maïs et l'un des deux sucres résultant de la décomposition du sucre de table, le saccharose, dans le corps.
Dans cette cascade, la première enzyme agit sur le glucose fourni à la cellule et les enzymes suivantes agissent sur les produits successifs. Dans le processus, deux molécules d'adénosine triphosphate - ATP - sont consommées mais quatre sont produites. L'hydrolyse de l'ATP alimente de nombreux processus cellulaires pour maintenir la viabilité de la cellule. Des cascades enzymatiques similaires sont responsables de nombreux processus métaboliques dans le corps.
Il a été démontré dans certains cas que les enzymes qui participent à de telles voies de réaction forment des enzymes intracellulaires, complexes réversibles appelés métabolons par Paul Srere (décédé), École de médecine du sud-ouest de l'Université du Texas. La proximité des enzymes facilite la série de réactions qu'elles catalysent. Un tel exemple est le purinosome découvert chez le professeur de l'Université Evan Pugh et titulaire de la chaire Eberly en chimie du laboratoire de Stephan J. Benkovic à Penn State, qui se compose de six enzymes impliquées dans la biosynthèse des purines.
Les chercheurs ont demandé si l'un des facteurs contribuant à la formation de métabolons pourrait être un gradient de produits chimiques générés par les enzymes participantes. Ils rapportent leurs résultats dans le numéro d'aujourd'hui (18 décembre) de Chimie de la nature .
"Nous avons découvert il y a quelque temps que de simples molécules catalytiques telles que des enzymes chimiotaxent également le gradient d'un réactif, " a déclaré Ayusman Sen, professeur distingué de chimie, État de Penn. "Ils se dirigent vers des concentrations de plus en plus élevées de réactif."
Le mouvement est appelé chimiotaxie, où les molécules individuelles migrent le long d'un gradient de concentration d'autres molécules.
"Tous les êtres vivants chimiotaxe, " a déclaré le sénateur. " Si vous avez faim et que vous sentez soudainement une odeur de frites, vous allez essayer de marcher vers les frites. Si l'odeur diminue, vous vous tournerez au hasard pour essayer de trouver la concentration la plus élevée de molécules d'odeur de frites jusqu'à ce que vous soyez au comptoir des frites. "
Dans leur étude, les chercheurs n'ont utilisé que les quatre premières enzymes de la voie glycolytique - l'hexokinase, phosphoglucose isomérase, phosphofructokinase et aldolase. Ces quatre étapes consomment réellement de l'ATP. Pour étudier le mouvement des enzymes, les chercheurs ont utilisé le marquage fluorescent de l'hexokinase et de l'aldolase, les première et quatrième enzymes de la voie. Chacun a été marqué avec un colorant fluorescent différent afin que le mouvement des deux enzymes puisse être suivi.
Ils ont examiné trois cas :la réaction normale où l'hexokinase phosphoryle le glucose; la réaction de l'hexokinase avec le mannose, un sucre qui se lie plus fortement mais a une vitesse de réaction plus lente; et enfin avec du L-glucose, une forme de glucose qui n'est pas utilisée par l'hexokinase. La phosphorylation nécessite de l'ATP. En présence de phosphoglucose isomérase - la deuxième enzyme - et de phosphofructokinase - la troisième enzyme - le réactif de l'aldolase est produit.
Les chercheurs ont observé que l'aldolase se déplace vers l'hexokinase dans leur expérience de flux, révélant que l'aldolase chimiotaxait le gradient de réactif produit par le fonctionnement des trois premières enzymes de la voie. La chimiotaxie était la plus élevée avec le D-glucose, moins avec le mannose et non observé avec le L-glucose.
La modélisation théorique du mouvement enzymatique a prédit qualitativement l'étendue du mouvement enzymatique.
Les chercheurs ont également examiné si la chimiotaxie des enzymes se produirait dans un modèle d'environnement intracellulaire exceptionnellement encombré. Ils ont ajouté une substance de poids moléculaire élevé pour simuler un tel encombrement. La chimiotaxie est toujours survenue, mais à un rythme plus lent.
"La chimiotaxie le long d'un gradient chimique pourrait être un facteur dans l'assemblage de clusters enzymatiques tels que les métabolons, " a déclaré Benkovic. " D'autres facteurs, telles que les interactions non covalentes devraient toujours contribuer. »
La résolution de l'instrument de recherche, cependant, était insuffisant pour démontrer dans ce cas que les quatre enzymes s'assemblaient en un métabolon. Les chercheurs ont observé la formation de gros agrégats d'enzymes, mais n'a pas pu démontrer qu'ils étaient des métabolons fonctionnels.