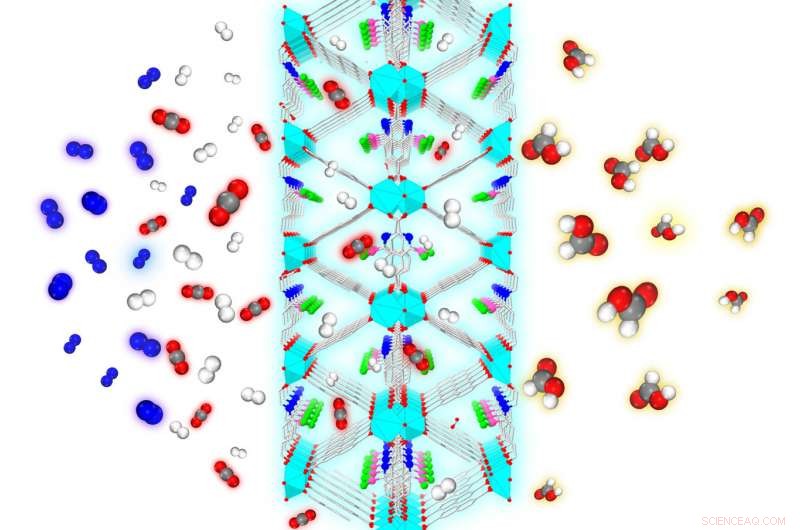
À partir de la gauche, un mélange de gaz, dont CO2 (rouge et gris), N2 (bleu), et H2 (blanc) sont exposés à la structure métallo-organique nanoporeuse conçue par le groupe Johnson. Seuls le CO2 et H2 entrent dans le MOF, qui rejette le N2. Les sites catalytiques de la charpente convertissent le CO2 en acide formique (rouge, gris et blanc), un précurseur chimique du méthanol Crédit :Swanson School of Engineering/Johnson Group
La combustion de combustibles fossiles tels que le charbon et le gaz naturel libère du carbone dans l'atmosphère sous forme de CO2, tandis que la production de méthanol et d'autres combustibles et produits chimiques précieux nécessite un approvisionnement en carbone. Il n'existe actuellement aucun moyen économiquement ou énergétiquement efficace de collecter le CO2 de l'atmosphère et de l'utiliser pour produire des produits chimiques à base de carbone, mais des chercheurs de la Swanson School of Engineering de l'Université de Pittsburgh viennent de franchir un pas important dans cette direction.
L'équipe a travaillé avec une classe de nanomatériaux appelés charpentes organométalliques ou "MOF, " qui peut être utilisé pour extraire le dioxyde de carbone de l'atmosphère et le combiner avec des atomes d'hydrogène pour le convertir en produits chimiques et carburants de valeur. Karl Johnson, le professeur William Kepler Whiteford au département de génie chimique et pétrolier de la Swanson School, a dirigé le groupe de recherche en tant que chercheur principal.
"Notre objectif ultime est de trouver une énergie basse, MOF à faible coût capable de séparer le dioxyde de carbone d'un mélange de gaz et de le préparer à réagir avec l'hydrogène, ", explique le Dr Johnson. "Nous avons trouvé un MOF qui pourrait légèrement plier les molécules de CO2, les amenant à un état dans lequel ils réagissent plus facilement avec l'hydrogène."
Le Johnson Research Group a publié ses découvertes dans le journal de la Royal Society of Chemistry (RSC) Science et technologie de la catalyse (DOI :10.1039/c8cy01018h). Le journal a présenté leur travail sur sa couverture, illustrant le processus des molécules de dioxyde de carbone et d'hydrogène entrant dans le MOF et sortant sous forme de CH2O2 ou d'acide formique, un précurseur chimique du méthanol. Pour que ce processus se produise, les molécules doivent surmonter un seuil énergétique exigeant appelé barrière d'hydrogénation.
Le Dr Johnson explique, "La barrière d'hydrogénation est l'énergie nécessaire pour ajouter deux atomes de H au CO2, qui transforme les molécules en acide formique. En d'autres termes, c'est l'énergie nécessaire pour réunir les atomes H et les molécules de CO2 afin qu'ils puissent former le nouveau composé. Dans nos travaux précédents, nous avons pu activer H2 en divisant deux atomes de H, mais nous n'avons pas été en mesure d'activer le CO2 jusqu'à présent."
La clé pour réduire la barrière d'hydrogénation était d'identifier un MOF capable de pré-activer le dioxyde de carbone. La pré-activation consiste essentiellement à préparer les molécules pour la réaction chimique en les plaçant dans la bonne géométrie, la bonne position, ou le bon état électronique. Le MOF qu'ils ont modélisé dans leur travail réalise une pré-activation du CO2 en le plaçant dans une géométrie légèrement courbée capable d'accepter les atomes d'hydrogène entrants avec une barrière inférieure.
Une autre caractéristique clé de ce nouveau MOF est qu'il réagit sélectivement avec les molécules d'hydrogène sur le dioxyde de carbone, afin que les sites actifs ne soient pas bloqués par le CO2. "Nous avons conçu un MOF qui a un espace limité autour de ses sites de liaison de sorte qu'il n'y a pas assez de place pour lier le CO2, mais il y a encore beaucoup de place pour lier H2, car il est tellement plus petit. Notre conception garantit que le CO2 ne se lie pas au MOF mais est plutôt libre de réagir avec les molécules H déjà à l'intérieur du cadre, " dit le Dr Johnson.
Le Dr Johnson pense que la mise au point d'un seul matériau capable à la fois de capturer et de convertir le CO2 serait économiquement viable et réduirait la quantité nette de CO2 dans l'atmosphère. « Vous pourriez capter le CO2 des fumées des centrales électriques ou directement de l'atmosphère, " dit-il. " Cette recherche restreint notre recherche d'un matériau très rare avec la capacité de transformer une technologie hypothétique en un réel avantage pour le monde. "