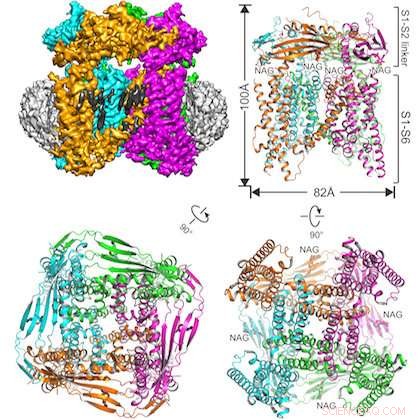
L'illustration montre la protéine étudiée intégrée dans une structure de nanodisque (en haut à gauche) et trois vues du canal ionique TRPML1 sous différents angles. Crédit :UT Sud-Ouest
Les chercheurs de l'UT Southwestern Medical Center ont publié aujourd'hui une structure atomique en 3D du canal ionique trouvé chez les mammifères qui est impliqué dans un rare, maladie neurodégénérative héréditaire chez l'homme. Le travail marque la première structure de ce type déterminée à l'aide de l'installation de cryomicroscopie électronique (cryo-EM) de 17 millions de dollars de l'université qui a ouvert ses portes l'année dernière.
En cryo-EM, les échantillons sont rapidement congelés pour empêcher la formation de cristaux de glace dommageables, puis visualisés à moins 321 degrés Fahrenheit (températures cryogéniques). L'installation de l'UT Southwestern, qui fonctionne 24 heures sur 24, est l'une des meilleures installations au monde pour la biologie structurale cryo-EM.
L'équipe interdisciplinaire a résolu la structure du canal ionique de souris TRPML1 (transient receptor potential mucolipin 1).
Leur étude, publié en ligne par La nature , survient juste une semaine après que trois développeurs de la technologie cryo-EM ont été récompensés par le prix Nobel de chimie 2017 pour leurs travaux sur les instruments et les méthodologies qui ont déclenché la « révolution de la résolution ». La cryo-EM permet des vues au niveau atomique des protéines qui résistent à la cristallisation nécessaire à la cristallographie aux rayons X traditionnelle.
"Des canaux ioniques fonctionnels sont nécessaires au bon mouvement des particules chargées électriquement - les ions - à l'intérieur et à l'extérieur des cellules et des organites pour exécuter les processus cellulaires, " a déclaré le Dr Youxing Jiang, Professeur de physiologie et biophysique, un chercheur au Howard Hughes Medical Institute (HHMI), et co-auteur de l'étude.
Le canal TRPML1, qui régule le flux d'ions calcium, se trouve chez tous les mammifères. Le canal se trouve dans la membrane des organites à l'intérieur des cellules appelées lysosomes, qui contiennent des enzymes qui aident au recyclage cellulaire en décomposant les grosses molécules.
Une cinquantaine de maladies de surcharge lysosomale (LSD) ont été identifiées chez l'homme, y compris une classe de LSD causée par des mutations de perte de fonction dans les gènes régissant les canaux TRPML1. Ce LSD, appelée mucolipidose de type IV, est marqué par un retard de développement des habiletés mentales et motrices et une déficience visuelle, selon les instituts nationaux de la santé.
"En raison de son lien avec cette classe de maladies de surcharge lysosomale, TRPML1 a été une cible potentielle pour les thérapies à petites molécules et plusieurs agonistes potentiels (ouvreurs de canaux) ont été développés, " a déclaré le Dr Jiang, un W.W. Caruth, Jr. Scholar en recherche biomédicale. La détermination de la structure de TRPML1 pourrait aider à la recherche de traitements pour la mucolipidose de type IV, il a dit.
L'installation cryo-EM d'UT Southwestern abrite trois instruments de haute technologie, dont un de 12½ pieds de haut, Titan Krios de 2 tonnes qui tire un faisceau de haute puissance à travers chaque échantillon tandis qu'une caméra spéciale capture des images des électrons dispersés qui en résultent. Un bras robotique à l'intérieur de la machine peut contenir et déplacer avec précision une douzaine d'échantillons surgelés de manière automatisée afin que des milliers d'images puissent être enregistrées, traitées par ordinateur, et interprété pour générer des images 3D à étudier, les chercheurs ont expliqué.

L'équipe de recherche de l'UTSW qui a déterminé la structure atomique 3-D d'un canal ionique comprend (rangée du bas, de gauche) Drs. Youxing Jiang et Xiaochen Bai, et (rangée du haut, de gauche) Jiangtao Guo, Quingfeng Chen, Weizhong Zeng, et Ji She. Crédit :UT Sud-Ouest
Une autre distinction dans cette étude est l'utilisation réussie d'une technique de préparation d'échantillons relativement nouvelle :l'incorporation de la protéine d'intérêt dans une structure de nanodisque faite de lipides et d'autres matériaux biologiques. Auteur principal Dr Qingfeng Chen, chercheur postdoctoral au laboratoire Jiang, créé l'échantillon.
"Pendant longtemps, un détergent a été utilisé pour extraire des protéines des membranes à des fins d'étude. Les gens ont suggéré que le détergent pourrait changer la structure de la protéine par rapport à son état natif, " a déclaré le Dr Xiaochen Bai, un professeur adjoint de biophysique et de biologie cellulaire et le deuxième auteur correspondant de l'étude. "Protéines membranaires, tels que ceux que nous avons étudiés, sont généralement enveloppés de lipides. Les nanodisques sont utilisés pour fournir un environnement natif pour l'échantillon de protéine."
Le Dr Bai est spécialisé dans le logiciel sophistiqué utilisé pour révéler l'organisation des atomes individuels au sein de chaque particule. Il a été recruté à l'UT Southwestern en tant que boursier du Cancer Prevention and Research Institute of Texas (CPRIT) et boursier Virginia Murchison Linthicum en recherche médicale après cinq années de formation au MRC Laboratory of Molecular Biology à Cambridge, ROYAUME-UNI.
Travaillant au sein d'une équipe développant ce qui est devenu l'un des meilleurs logiciels de traitement des données d'images générées par la microscopie électronique, Le Dr Bai a eu de nombreuses conversations avec le Dr Richard Henderson, l'un des trois scientifiques a reçu le prix Nobel de chimie la semaine dernière.
"Il a passé jour et nuit dans le laboratoire à travailler sur le développement de méthodes pour cryo-EM. L'une de ses grandes contributions a été le développement d'un nouveau type d'appareil photo pour prendre de meilleures photos des protéines étudiées avec cryo-EM, " a déclaré le Dr Bai. "Quand j'ai déménagé pour la première fois en Angleterre, il m'a donné beaucoup de conseils et de soutien et nous avons eu de nombreuses discussions sur les techniques de cryo-EM."