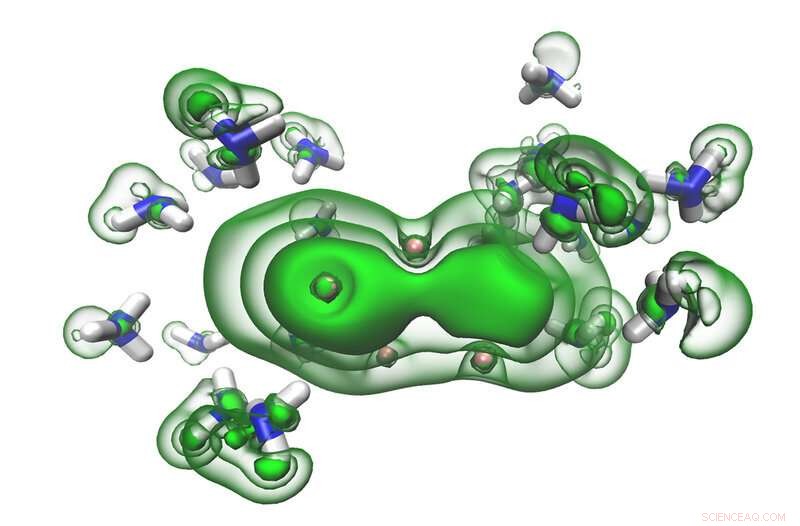
Les électrons solvatés (verts) dans les espaces entre les molécules d'ammoniac (bleus et blancs) commencent à fusionner en une paire à mesure qu'une solution devient métallique. Crédit :Ryan McMullen
Ryan McMullen n'avait jamais entendu parler de l'USC Dornsife College of Letters, Arts et sciences lorsqu'il a commencé à rechercher un programme d'études supérieures en chimie. Mais sur recommandation d'un de ses professeurs, il a envoyé un courriel au professeur de chimie du Collège, Stephen Bradforth, proposant une expérience pour découvrir ce qui fait qu'un métal est vraiment un métal.
La proposition ne se transformerait pas seulement en son doctorat. thèse, mais une percée scientifique majeure.
La proposition de McMullen n'était pas une vente facile. L'expérience serait coûteuse et peut-être dangereuse.
Les universitaires contactés par McMullen dans d'autres universités de recherche américaines lui ont dit qu'ils disposaient d'un financement pour leurs propres recherches, mais pas pour le sien. Mais Bradforth a eu une réponse différente.
"Il a dit, « Je n'ai pas de financement pour votre idée, mais si vous venez ici, nous pouvons rédiger une proposition de financement ensemble, '", a déclaré McMullen, qui à l'époque terminait ses études de premier cycle à l'Université de Bristol au Royaume-Uni.
Bradforth a non seulement aidé McMullen à obtenir un financement, en lui accordant la priorité pour le soutien de la National Science Foundation à la poursuite d'autres projets, mais il a également concocté une équipe internationale de scientifiques et a organisé son congé sabbatique pour superviser et participer aux principales expériences. Il est également devenu le Ph.D de McMullen. conseiller.
Bradforth a reconfiguré son laboratoire pour protéger ses scientifiques. L'expérience nécessitait de l'ammoniac liquide, qui peut être légèrement toxique, et métal alcalin, qui peut exploser s'il touche de l'eau.
« Mon laboratoire a l'air différent à cause de cela, " a noté Bradforth, qui est également doyen de division pour les sciences naturelles et les mathématiques.
L'effort valait bien le résultat. L'expérience a révélé des découvertes qui sont "le genre de choses qui vont dans les manuels, ou au moins change la façon dont les manuels sont écrits, " Bradforth a dit, notant l'importance potentiellement historique de l'œuvre. Il gagnerait également la distinction convoitée d'être la couverture du magazine Science le 5 juin.
Plein de métal
Le projet s'est penché sur une question fondamentale :quelles propriétés sont inhérentes à un métal et lesquelles sont accessoires ?
L'intuition suggère que les métaux sont denses, et bien que cela soit vrai pour certains (pensez à l'or ou au plomb), il ne tient pas pour les autres. Par exemple, le lithium, couramment utilisé dans les batteries, flotte sur l'eau. Certains métaux sont durs, comme le titane, d'autres encore cèdent facilement à la pression, y compris l'indium et l'aluminium. Et la température de fusion ? Le platine fond à plus de 1, 700 degrés Celsius (3, 200F), mais le mercure est un liquide bien au-dessous de zéro.
De nombreuses autres définitions de « capot métallique » souffrent de contradictions similaires, mais seuls les métaux sont capables de conduire l'électricité. Conduction, contrairement à la densité ou à la dureté, est une propriété inhérente à tous les métaux.
Cherchant à mieux comprendre les propriétés intrinsèques des métaux, Bradforth, McMullen et leurs collègues ont utilisé une astuce notée pour la première fois par le chimiste Sir Humphry Davy en 1809. En substance, ils ont fait un métal à partir de zéro.
Les scientifiques ont refroidi l'ammoniac - normalement un gaz à température ambiante - à moins 33 °C pour le liquéfier, puis ont ajouté :dans des expériences séparées, les métaux alcalins lithium, sodium et potassium.
Dans ces solutions, les électrons du métal alcalin sont initialement piégés dans les espaces entre les molécules d'ammoniac. Cela crée ce que les scientifiques appellent des «électrons solvatés, ' qui sont très réactifs mais stabilisés dans l'ammoniac. Ces solutions ont une couleur bleue caractéristique. Mais avec suffisamment d'électrons solvatés, tout le liquide vire au bronze et, en substance, devient un métal tout en restant liquide.
Les électrons solvatés se sont avérés importants pour les chimistes organiques. Grâce à une réaction appelée « réduction du bouleau, " du nom du chimiste Arthur Birch, ils ont joué un rôle clé dans la synthèse de nombreux composés importants et ont conduit à la fabrication de contraceptifs oraux dans les années 1950.
Rayonner sur les électrons
Les scientifiques ont ensuite mesuré la quantité d'énergie nécessaire pour extraire les électrons solvatés de l'ammoniac métallique à l'aide d'un faisceau de rayons X extrêmement brillant et focalisé basé à Berlin.
Dans une toute première expérience, ils ont forcé différentes concentrations de l'ammoniac métallique à travers un microjet, qui a créé un flux de la largeur d'un cheveu humain qui a ensuite traversé un faisceau de rayons X aussi fin qu'un cheveu.
Les résultats ont montré que, à de faibles concentrations, les électrons solvatés étaient plus facilement délogés de la solution par l'interaction avec les rayons X, donnant un schéma énergétique simple. À des concentrations plus élevées, bien que, le modèle d'énergie a soudainement développé un bord de bande net, indiquant que la solution se comportait comme le ferait un métal.
Bien que les implications pratiques du résultat nécessitent des recherches plus approfondies, l'expérience ouvre une nouvelle fenêtre permettant aux chimistes de synthétiser des composés organiques importants. Tout comme la réduction de Birch a conduit aux contraceptifs oraux, donc, trop, cette expérience pourrait-elle conduire à de nouveaux composés utilisables d'un nombre incalculable de façons.
Jersey Garçon
McMullen, originaire de Jersey (l'original européen, pas l'état voisin de New York), prévoit de retourner dans son laboratoire à l'USC Dornsife dans quelques semaines. Mais il n'a pas laissé la pandémie de COVID-19 le ralentir. Toujours curieux de savoir comment fonctionne l'électronique, il a fait des expériences - en toute sécurité, bien sûr, depuis son appartement à Long Beach, Californie, en utilisant des composants qu'il a achetés sur e-Bay.
Après avoir terminé son doctorat, McMullen, le premier de sa famille à fréquenter l'université, envisage de poursuivre un stage postdoctoral, bien qu'il ne sache pas où ni sur quoi il se concentrera. Il sait, cependant, qu'il veut rester dans le monde universitaire. Où qu'il atterrisse, il est presque certain que le monde de la chimie entendra à nouveau parler de lui.
"J'aime faire les choses exotiques."