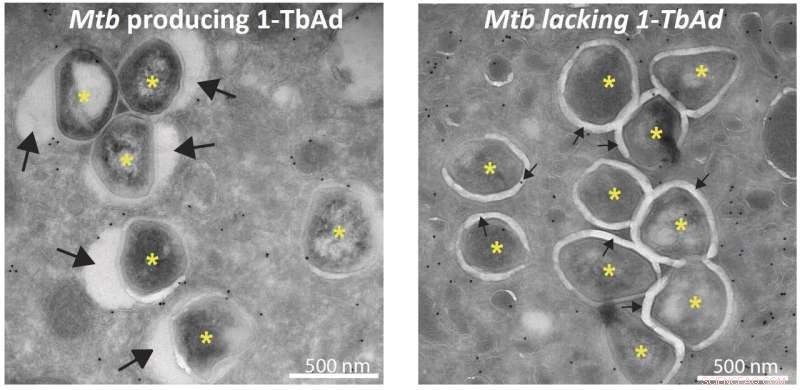
Photos de microscopie électronique montrant que les bactéries (*) productrices de 1-TbAd sont entourées d'un phagosome gonflé (grosses flèches, photo de gauche) et les bactéries ne produisant pas de 1-TbAd sont entourées de phagosomes serrés (petites flèches, image de droite). Crédit :Buter et al. / Nature Chimie Biologie
En 2017, quelque 10 millions de personnes souffraient de tuberculose et 1,6 million en sont mortes. L'une des raisons pour lesquelles l'infection par Mycobacterium tuberculosis est si difficile à traiter est que la bactérie peut se cacher à l'intérieur des cellules immunitaires. scientifiques de l'Université de Groningue, avec une équipe du service de rhumatologie, immunologie et allergie dirigé par le professeur D. Branch Moody à la Harvard Medical School et plusieurs autres collègues, ont maintenant découvert un mécanisme clé dans les bactéries qui empêche les cellules immunitaires de les tuer :les bactéries produisent un type unique d'antiacide qui donne aux cellules immunitaires une indigestion. Les résultats ont été publiés dans Nature Chimie Biologie le 19 août 2019.
Les bactéries envahissantes sont englouties par des cellules immunitaires appelées macrophages. Ils encapsulent les intrus dans un phagosome, une vésicule qui fusionne alors avec une autre vésicule pleine d'enzymes, le lysosome. Après cette fusion, les enzymes décomposent les bactéries. Mais pas dans le cas de Mycobacterium tuberculosis :« Ils peuvent survivre des années à l'intérieur d'un macrophage, où les antibiotiques peuvent à peine les atteindre, " explique Jeffrey Buter, chimiste de l'Université de Groningue, premier auteur de l'article. Il a travaillé pendant des années sur la tuberculose à Groningue sous la direction du professeur Adri Minnaard, ainsi qu'à la Harvard Medical School, supervisé par le professeur David Branch Moody. Les deux superviseurs sont co-auteurs principaux du nouveau document.
Virulence
Dans une étude précédente publiée en 2014, l'équipe a identifié des lipides présents chez M. tuberculosis mais pas chez M. bovis, une bactérie beaucoup moins virulente. Les lipides spécifiques de M. tuberculosis pourraient jouer un rôle dans la virulence. En effet, un candidat important a été trouvé et identifié comme la 1-tuberculosinyladénosine (1-TbAd), une adénosine modifiée par la fixation d'un lipide en position 1. "Une telle modification est de nature extrêmement rare, " dit Buter, "pourtant, M. tuberculosis produit et libère une quantité relativement importante de ce composé."
Deux enzymes essentielles à la production de 1-TbAd ont été identifiées, mais le mécanisme par lequel cette molécule a aidé la bactérie de la tuberculose à survivre restait un mystère. "Puis, nous avons trouvé des recherches effectuées par un autre groupe en 2004, dans lequel il a été montré que la fusion du phagosome et du lysosome était bloquée en raison de ces enzymes. Comme le phagosome doit être acide pour la fusion, cela nous a conduit à l'hypothèse que le 1-TbAd jouait un rôle dans la prévention de l'acidification du phagosome."
Antiacide
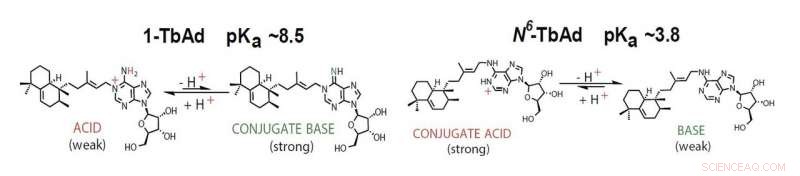
Le 1-TbAd agit comme un acide ou une base conjuguée selon l'acidité du milieu. Crédit :Buter et al / Nature Chimie Biologie
'1-TbAd est un acide faible et en équilibre avec son homologue basique, " poursuit Buter. " Dans le milieu acide du phagosome, cette base réduira l'acidité. » Cette découverte suggère que la molécule fonctionne comme un antiacide et empêche le phagosome d'atteindre le niveau d'acidité requis pour fusionner avec le lysosome.
Le groupe a effectué une série d'expériences pour exclure la possibilité que le composé d'adénosine ait agi par l'intermédiaire d'un récepteur. Les résultats ont confirmé que 1-TbAd fonctionne en effet en réduisant directement l'acidité. Buter a synthétisé différentes variantes de la molécule pour déterminer quelles parties de la molécule étaient vitales pour sa fonction. "La partie lipidique est nécessaire pour traverser les membranes et pénétrer dans les phagosomes et les lysosomes, " dit Buter.
Paludisme
Des études de microscopie réalisées dans le laboratoire de Nicole van der Wel à l'UMC d'Amsterdam révèlent que l'exposition des macrophages à 1-TbAd fait gonfler leurs lysosomes jusqu'à cinq fois leur taille normale. Des tests avec des macrophages infectés par M. tuberculosis montrent que les phagosomes ne gonflent significativement qu'en présence de l'enzyme Rv3378c nécessaire à la production de 1-TbAd. « Il existe plusieurs mécanismes empêchant les macrophages de tuer M. tuberculosis, mais nous avons découvert ce qui semble être un mécanisme clé pour la survie bactérienne."
De façon intéressante, le mécanisme par lequel 1-TbAd agit est le même que la façon dont la chloroquine tue le parasite du paludisme. "Ce médicament bloque le fonctionnement des lysosomes du parasite." Cela suggère que 1-TbAd pourrait être utilisé comme médicament antipaludique. "Mais aussi, cibler la production de 1-TbAd pourrait tuer M. tuberculosis à l'intérieur des macrophages. L'enzyme Rv3378c serait une cible intéressante pour la découverte de médicaments, car l'enzyme est unique à la bactérie de la tuberculose."