
Les scientifiques Emiliana Fabbri et Thomas Schmidt dans un laboratoire du PSI où ils ont mené des expériences pour étudier les performances du catalyseur nouvellement développé pour les électrolyseurs. Crédit :Institut Paul Scherrer/Mahir Dzambegovic
Des technologies de stockage efficaces sont nécessaires si l'énergie solaire et éolienne doit aider à satisfaire les demandes croissantes d'énergie. Une approche importante est le stockage sous forme d'hydrogène extrait de l'eau à l'aide de l'énergie solaire ou éolienne. Ce processus a lieu dans un électrolyseur. Grâce à un nouveau matériau développé par des chercheurs de l'Institut Paul Scherrer PSI et de l'Empa, ces appareils sont susceptibles de devenir moins chers et plus efficaces à l'avenir. Le matériau en question fonctionne comme un catalyseur accélérant la séparation des molécules d'eau :la première étape de la production d'hydrogène. Les chercheurs ont également montré que ce nouveau matériau peut être produit de manière fiable en grande quantité et ont démontré sa capacité de performance au sein d'une cellule d'électrolyse technique, le composant principal d'un électrolyseur. Les résultats de leurs recherches ont été publiés dans l'édition actuelle de la revue scientifique Matériaux naturels .
L'énergie solaire et éolienne n'étant pas toujours disponible, il ne contribuera de manière significative à la satisfaction des besoins énergétiques qu'une fois qu'un mode de stockage fiable aura été mis au point. Une approche prometteuse de ce problème est le stockage sous forme d'hydrogène. Ce procédé nécessite un électrolyseur, qui utilise l'électricité produite par l'énergie solaire ou éolienne pour diviser l'eau en hydrogène et oxygène. L'hydrogène sert de vecteur d'énergie. Il peut être stocké dans des réservoirs et ensuite retransformé en énergie électrique à l'aide de piles à combustible. Ce processus peut être effectué localement, dans les endroits où l'énergie est nécessaire comme les résidences domestiques ou les véhicules à pile à combustible, permettant une mobilité sans émission de CO2.
Pas cher et efficace
Des chercheurs de l'Institut Paul Scherrer PSI viennent de mettre au point un nouveau matériau qui fonctionne comme un catalyseur au sein d'un électrolyseur et accélère ainsi la séparation des molécules d'eau :la première étape de la production d'hydrogène. « Il existe actuellement deux types d'électrolyseurs sur le marché :l'un est efficace mais cher car ses catalyseurs contiennent des métaux nobles comme l'iridium. Les autres sont moins chers mais moins efficaces », explique Emiliana Fabbri, chercheur à l'Institut Paul Scherrer. "Nous voulions développer un catalyseur efficace mais moins cher qui fonctionne sans utiliser de métaux nobles."

Nanoparticules d'une pérovskite pouvant être utilisées comme catalyseur efficace pour les électrolyseurs. L'encart montre un grossissement. Crédit :Institut Paul Scherrer/Emiliana Fabbri
En explorant cette procédure, les chercheurs ont pu utiliser un matériau qui avait déjà été développé :un composé complexe des éléments baryum, strontium, cobalt, du fer et de l'oxygène – ce qu'on appelle la pérovskite. Mais ils ont été les premiers à mettre au point une technique permettant sa production sous forme de minuscules nanoparticules. C'est la forme requise pour qu'il fonctionne efficacement car un catalyseur nécessite une grande surface sur laquelle de nombreux centres réactifs sont capables d'accélérer la réaction électrochimique. Une fois que les particules de catalyseur individuelles ont été rendues aussi petites que possible, leurs surfaces respectives se combinent pour créer une surface globale beaucoup plus grande.
Les chercheurs ont utilisé un appareil dit de pulvérisation de flamme pour produire cette nanopoudre :un appareil exploité par l'Empa qui envoie les éléments constitutifs du matériau à travers une flamme où ils fusionnent et se solidifient rapidement en petites particules une fois qu'ils quittent la flamme. "Nous devions trouver un mode de fonctionnement du dispositif qui garantisse de manière fiable la solidification des atomes des différents éléments dans la bonne structure, " souligne Fabbri. " Nous avons également pu faire varier la teneur en oxygène si nécessaire, permettant la production de différentes variantes de matériaux."
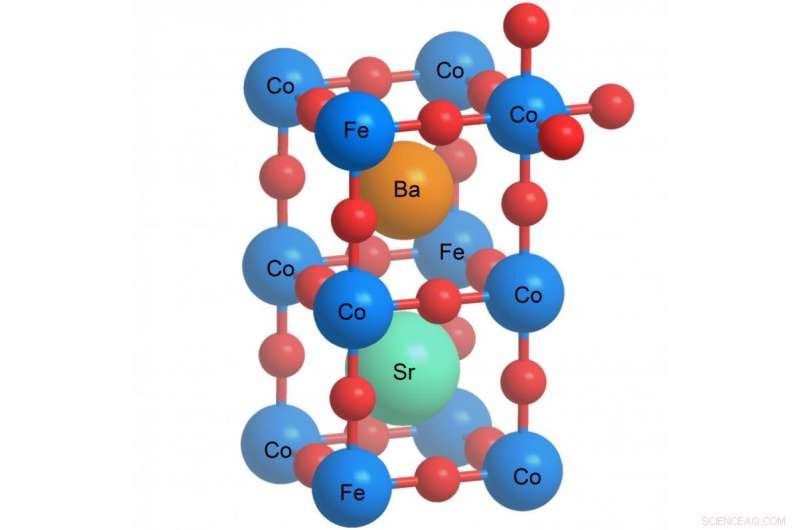
Structure d'une pérovskite. Les symboles chimiques correspondent au matériau étudié. Les boules rouges représentent l'oxygène. Crédit :Institut Paul Scherrer/Emiliana Fabbri
Tests sur le terrain réussis
Les chercheurs ont pu montrer que ces procédures fonctionnent non seulement en laboratoire mais aussi en pratique. Le procédé de production fournit de grandes quantités de poudre de catalyseur et peut être facilement disponible pour une utilisation industrielle. « Nous étions impatients de tester le catalyseur dans des conditions de terrain. Bien sûr, nous avons des installations d'essai au PSI capables d'examiner le matériau, mais sa valeur dépend en fin de compte de son adéquation aux cellules d'électrolyse industrielles utilisées dans les électrolyseurs commerciaux, ", explique Fabbri. Les chercheurs ont testé le catalyseur en coopération avec un fabricant d'électrolyseurs aux États-Unis et ont pu montrer que l'appareil fonctionnait de manière plus fiable avec la nouvelle pérovskite produite par PSI qu'avec un catalyseur conventionnel à base d'oxyde d'iridium.
Examen en millisecondes
Les chercheurs ont également pu réaliser des expériences précises qui ont fourni des informations précises sur ce qui se passe dans le nouveau matériau lorsqu'il est actif. Cela impliquait d'étudier le matériau avec des rayons X à la source de lumière suisse SLS du PSI. Cette installation offre aux chercheurs une station de mesure unique capable d'analyser l'état d'un matériau sur des périodes successives de seulement 200 millisecondes. « Cela nous permet de suivre l'évolution du catalyseur au cours de la réaction catalytique :on peut observer des modifications des propriétés électroniques ou de l'arrangement des atomes, " dit Fabbri. Dans d'autres installations, chaque mesure individuelle prend environ 15 minutes, ne fournissant au mieux qu'une image moyenne." Ces mesures ont également montré comment les structures des surfaces des particules changent lorsqu'elles sont actives - des parties du matériau deviennent amorphes, ce qui signifie que les atomes dans les zones individuelles ne sont plus disposés de manière uniforme. De manière inattendue, cela fait du matériau un meilleur catalyseur.