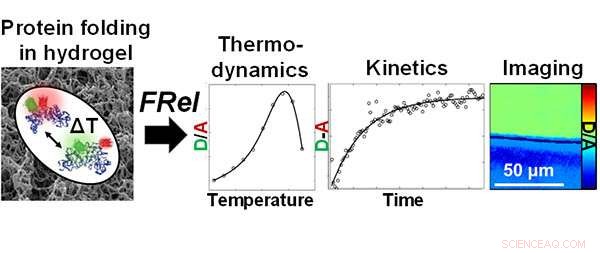
Des chercheurs de l'Institut Beckman de l'Université de l'Illinois ont utilisé l'imagerie par relaxation rapide (FReI) pour étudier la stabilité du repliement et la dynamique des protéines dans les hydrogels de polyacrylamide. Crédit :Lydia Kisley, Institut Beckman pour la science et la technologie avancées
Les hydrogels sont des matériaux polymères qui peuvent absorber une grande quantité d'eau, les rendant flexibles comme des tissus humains. Ils sont utilisés dans un certain nombre d'applications médicales, y compris les lentilles de contact, pansements, et reconstruction faciale.
Les hydrogels peuvent également être utilisés dans l'administration de médicaments, par exemple, comme revêtements pour médicaments. Cependant, des questions subsistent quant à l'efficacité de l'administration du médicament, car il n'est pas clair comment les protéines de votre corps interagissent avec les hydrogels.
"Si vous mettez un hydrogel dans votre corps, il y a des protéines dans votre corps qui peuvent alors interagir avec ce matériau, " dit Lydia Kisley, un boursier postdoctoral interdisciplinaire Beckman-Brown. "Idéalement, vous voulez que les protéines maintiennent leur fonction et leur structure, donc il n'y a pas d'effets indésirables."
Kisley, un chimiste, et d'autres chercheurs du Beckman Institute for Advanced Science and Technology de l'Université de l'Illinois ont récemment utilisé l'imagerie par relaxation rapide (FReI) pour étudier la stabilité du repliement et la dynamique des protéines dans les hydrogels de polyacrylamide. Leurs résultats sont publiés dans "Direct Imaging of Protein Stability and Folding Kinetics in Hydrogels" dans Matériaux et interfaces appliqués ACS .
"Nous essayons de comprendre comment les protéines se comportent dans ces environnements matériels, " dit Kisley. " Il n'y a pas beaucoup d'outils disponibles pour faire ça. Cet article était la première démonstration de la nouvelle technique d'imagerie pour comprendre les protéines dans un matériau."
Le groupe a utilisé un microscope à fluorescence dans le laboratoire de Martin Greubele, professeur de chimie et membre du groupe de nanoélectronique et de nanomatériaux de Beckman. FReI détecte le dépliement des protéines in situ par imagerie des changements dans le transfert d'énergie de résonance de fluorescence (FRET) après des perturbations de saut de température.
Utilisation de l'imagerie de relaxation rapide (FReI), des chercheurs du Beckman Institute for Advanced Science and Technology de l'Université de l'Illinois ont étudié la stabilité du repliement et la dynamique des protéines dans les hydrogels de polyacrylamide. Crédit :Lydia Kisley, Institut Beckman pour la science et la technologie avancées
"La chose unique que nous ajoutons ici avec le microscope est un changement de température. En utilisant ce changement de température très rapide, nous pouvons dire comment la protéine réagit à la température et à quel point elle est stable. Et comment le confinement et la chimie de l'hydrogel modifient également la stabilité des protéines, " dit Kisley.
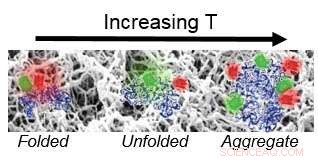
La fonction de la protéine vient de la façon dont elle est repliée, Kisley a expliqué. Afin de comprendre comment fonctionnent les protéines qui composent certains médicaments, il est crucial de comprendre comment ils se replient.
Le groupe a déterminé que l'hydrogel augmente la stabilité des protéines, accélère la relaxation de pliage, et favorise une liaison irréversible à l'interface solution-gel.
« Bien que ces matériaux soient très compatibles, car ils ont une forte teneur en eau, nous avons constaté qu'à basse température, lorsque la protéine est dépliée, tout va bien, mais une fois que la protéine commence à se déployer un peu, elle commencera à coller au matériau, et peut en fait favoriser l'agrégation de plus de protéines et leur adhérence, cela suggère donc que la protéine est un peu déstabilisée, " dit Kisley.
"C'était un système plus compliqué que prévu. Je pensais que ce serait simple, mais c'est assez courant en science où les choses finissent par être plus compliquées que prévu."
La bourse de Kisley à l'Institut Beckman lui a permis de relier sa recherche doctorale sur la diffusion et l'adsorption des protéines dans les hydrogels au repliement des protéines dans les hydrogels et à d'autres échantillons de surface et de brosse en polymère.
Elle prévoit d'étudier si les comportements que nous voyons dans un gel 3D plus grand se produisent également sur une surface plus petite, environnement à l'échelle nanométrique.