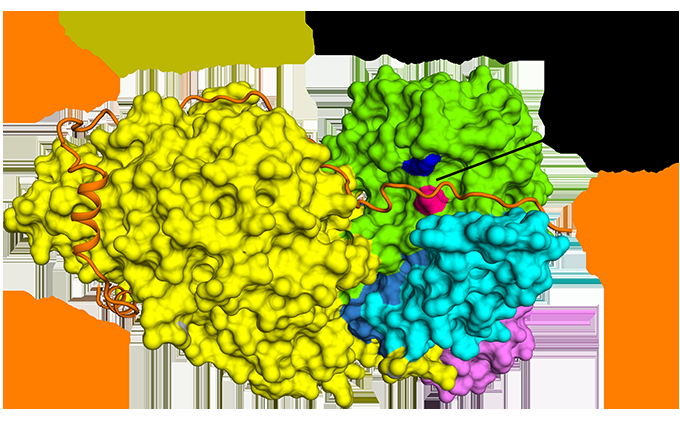
Figure 1 :La liaison antiparallèle de la sécurine par rapport à la séparase. Crédit :Source de lumière diamant
La structure d'un complexe protéique important qui régule la transition métaphase à anaphase au cours de la progression du cycle cellulaire a été résolue à l'aide de la microscopie cryoélectronique (cryo-EM) à Diamond Light Source. L'étude structurelle, détaillé dans Nature Biologie structurale et moléculaire , a fourni des informations précieuses sur le fonctionnement interne du complexe séparase-sécurine.
La séparase est une enzyme responsable du clivage des sous-unités kleisine (Scc1 et Rec8) de l'anneau de cohésine qui maintient ensemble les chromatides sœurs pendant la mitose. Une fois les chromatides libérées par separase, ils se séparent vers les pôles opposés de la cellule, prêt à former de nouveaux noyaux dans deux cellules filles identiques. La séparase est contrôlée par un chaperon inhibiteur appelé sécurine, qui est curieusement également soupçonné d'avoir des propriétés activatrices.
Bien que découvert il y a près de 20 ans, ce n'est que récemment que la structure de la séparase liée à la sécurine a été élucidée. La cryo-EM a été entreprise au Centre de bio-imagerie électronique (eBIC) de Diamond pour déterminer la structure du complexe complet et explorer l'interaction moléculaire entre la séparase et la sécurine. Il a été découvert que la sécurine forme une conformation étendue pour interagir sur toute la longueur de la séparase, et inhibe l'enzyme par un mécanisme de pseudo-substrat au site actif. Une compréhension complète de cette interaction et de la nature du contrôle du cycle cellulaire pourrait ouvrir de nouvelles voies pour la conception de médicaments ciblés.
Un complexe régulateur du cycle cellulaire
Lorsque les chromosomes sont répliqués, ils contiennent chacun deux chromatides sœurs, et au cours de la division cellulaire, ces chromatides doivent se séparer de manière coordonnée et précise pour produire deux noyaux filles identiques. Au début de la mitose, les chromatides sœurs sont maintenues ensemble par un complexe protéique appelé cohésine; cependant, pendant la transition métaphase à anaphase, la cohésine est clivée par une enzyme protéase connue sous le nom de séparase pour séparer les chromatides et leur permettre de se déplacer vers les côtés opposés de la cellule juste avant qu'elle ne se divise.
La transition de la métaphase à l'anaphase commence lorsqu'une grande ubiquitine ligase E3 multi-sous-unités, appelé complexe promoteur de l'anaphase (ou APC/C) marque un chaperon inhibiteur, appelé sécurine, avec l'ubiquitine pour la destruction. Une fois la sécurine dégradée, separase est libre de cliver la cohésine et de séparer les chromatides.
Le complexe séparase-sécurine est essentiel pour la division cellulaire, pourtant la structure de ce duo n'avait pas été résolue dans son intégralité. Dr Andreas Boland, Un chercheur postdoctoral dans le groupe du Dr David Barford au Laboratoire de biologie moléculaire du MRC et co-investigateur principal de l'étude a expliqué pourquoi ce complexe est si fascinant :« La mauvaise ségrégation du matériel génétique peut conduire à l'aneuploïdie et à la tumorigenèse, c'est donc l'une des étapes les plus importantes de la progression du cycle cellulaire. Paradoxalement, la sécurine prévient non seulement le clivage prématuré de la cohésine, mais il peut aussi favoriser l'activité séparase. Pour comprendre en détail les doubles mécanismes d'activation et de répression, nous avons utilisé la cryo-EM à une particule."
Structure cryo-EM à une résolution de 3,8-Å
Des complexes séparase-sécurine de C. elegans et d'humains ont été exprimés, purifié, et appliqués à des grilles de carbone en or recouvertes d'oxyde de graphène avant d'être congelés rapidement dans de l'éthane liquide. Des micrographies cryo-EM ont été collectées à l'aide du microscope Titan Krios à eBIC avec un grossissement calibré de 47, 619, ce qui correspondait à une taille de pixel de 1,05 .
Le Dr Boland a souligné l'intérêt de la cryo-EM pour cette application :« Les complexes protéiques sont de taille relativement petite, avec moins de 250 kDa pour l'humain et seulement environ 150 kDa pour le complexe C. elegans, mais ils contiennent plusieurs domaines et sont flexibles, ils étaient donc des matériaux difficiles à cristalliser. La cryo-EM est une option réalisable, même pour de petits complexes protéiques comme celui-ci."
Pour la toute première fois, La cryo-EM a été utilisée pour déterminer la structure de résolution quasi atomique du complexe séparase-sécurine de C. elegans. Par ailleurs, la structure de l'équivalent humain du complexe a été résolue à une résolution moyenne, révélant la conservation évolutive de la forme triangulaire de la séparase.
Cryo-EM a permis à l'équipe de visualiser comment la sécurine interagit avec la séparase. Il adopte une conformation anti-parallèle étendue pour se lier aux patchs hydrophobes sur toute la longueur de la séparase. Avec curiosité, il a également été démontré que ces interactions hydrophobes stabilisent la séparase, expliquant potentiellement les effets activateurs de la sécurine sur la séparase. De plus, la sécurine interagit avec le site catalytique de la séparase via un mécanisme de pseudo-substrat. Un résidu arginine présent à la position de clivage P1 dans les substrats de cohésine Scc1 et Rec8 est remplacé dans la sécurine par un résidu hydrophobe. Cette substitution est responsable de la distorsion de la géométrie du site catalytique de la séparase à la position de clivage du substrat, bloquant ainsi son activité protéasique.
La séparase est cruciale pour la progression du cycle cellulaire, il pourrait donc s'agir d'une cible pharmaceutique intéressante. Mutation, surexpression, et la mauvaise localisation de la séparase se sont avérées être associées à des développements tumoraux tels que le cancer du sein.
Le Dr Boland prévoit de poursuivre l'étude du complexe :« À l'avenir, nous voulons améliorer la résolution du complexe humain séparase-sécurine pour atteindre une résolution atomique ou quasi atomique. Nous aimerions également comprendre comment le complexe séparase-sécurine est lié et ubiquitiné par l'APC/C pour le marquer pour destruction, nous continuerons donc à utiliser cryo-EM à cette fin. »