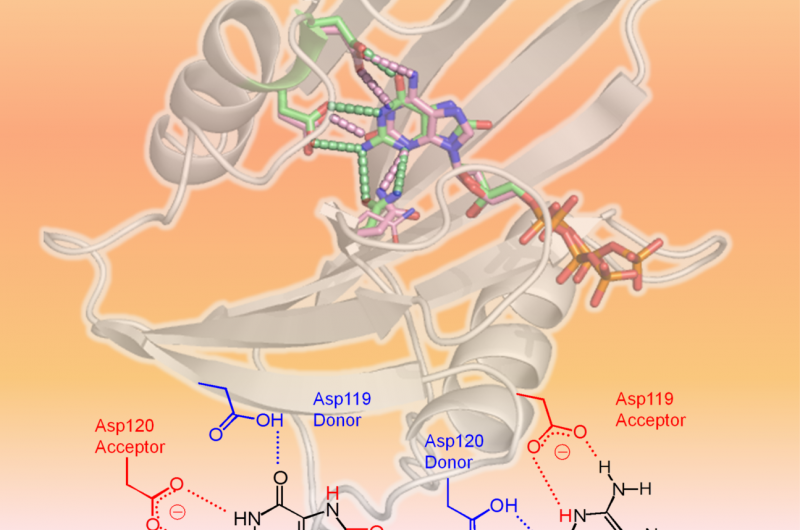
hMTH1 reconnaît deux dNTP oxydés comme indiqué dans la structure 3-D (zone supérieure de la figure :hMTH1, ruban; dNTP endommagés, des bâtons). Le facteur déterminant dans la large spécificité du substrat réside dans les différents états de protonation entre Asp-119 et Asp-120 (zone inférieure de la figure). Crédit :Professeur Yuriko Yamagata
La protéine homologue MutT humaine 1 (hMTH1) agit comme l'enzyme principale pour décomposer (hydrolyser) les désoxynucléosides triphosphates (dNTP) endommagés (oxydés) les substrats de la synthèse de l'ADN. Récemment, hMTH1 a attiré l'attention en tant que cible populaire pour les nouvelles thérapies anticancéreuses car il n'est pas essentiel pour les cellules normales, mais les cellules cancéreuses en ont besoin pour éviter d'incorporer des nucléotides oxydés dans l'ADN, ce qui entraînerait la mort des cellules cancéreuses. Maintenant, Les inhibiteurs de hMTH1 sont développés en tant que candidats médicaments anticancéreux. Même si certains rapports contestent l'utilité de l'inhibition de hMTH1, inhibiteurs très puissants et sélectifs de hMTH1, qui permettrait l'introduction de nucléotides oxydés dans l'ADN des cellules cancéreuses, sont attendus pour les futurs traitements contre le cancer.
Les enzymes sont généralement très particulières quant au matériau qu'elles catalysent (substrat). Certains, cependant, peut catalyser plus d'un substrat, et hMTH1 est connu pour hydrolyser plusieurs dNTP oxydés. Les raisons de la large spécificité du substrat n'avaient pas encore été explorées lorsque les chercheurs japonais ont commencé à examiner la question.
Des scientifiques de l'Université de Kumamoto, les Instituts nationaux des sciences et technologies quantiques et radiologiques, et l'Université de Kyushu a effectué des analyses structurelles et cinétiques sur hMTH1 pour déterminer les mécanismes derrière sa capacité à hydrolyser divers dNTP mutagènes oxydés, tels que le 8-oxo-dGTP et le 2-oxo-dATP, avec une efficacité similaire. Leurs expériences ont montré que l'état de protonation entre les résidus d'aspartate Asp-119 et Asp-120 était le facteur déterminant de la large spécificité de substrat de hMTH1. En d'autres termes, l'ajout ou la suppression d'un ou plusieurs protons à Asp-119 ou Asp-120 est ce qui amène hMTH1 à reconnaître 8-oxo-dGTP ou 2-oxo-dATP. Cela permet à hMTH1 d'hydrolyser les dNTP mutagènes oxydés avant qu'ils ne soient utilisés pour la synthèse d'ADN; L'ADN qui contient des nucléotides oxydés provoquerait la mort des cellules cancéreuses.
"Nous avons découvert que différents états de protonation entre Asp-119 et Asp-120 sont le signal pour que hMTH1 hydrolyse les nucléotides endommagés. Si cette action de hMTH1 peut être supprimée, les cellules cancéreuses accumuleraient des nucléotides endommagés et finiraient par subir une apoptose, " a déclaré le professeur Yuriko Yamagata de l'Université de Kumamoto, chef du groupe de recherche. "La clarification de ce mécanisme devrait aider au développement de hMTH1 ciblant les médicaments anticancéreux."