Depuis leur découverte, les chercheurs ont démontré à plusieurs reprises les applications médicales potentielles des cellules et tissus différenciés générés à partir de cellules souches pluripotentes induites (iPS). Cependant, un obstacle important aux applications médicales réelles est lié au substrat utilisé pour cultiver et induire les cellules iPS en types de cellules différenciées.
En particulier, bien que des protocoles de différenciation générant des myocytes et des cellules souches musculaires (MuSC) à partir de cellules iPS aient été rapportés, ils restent relativement peu efficaces et nécessitent l'utilisation d'un substrat d'origine animale populaire appelé Matrigel.
Pour aller de l'avant, des protocoles d'induction plus efficaces et une transition vers des substrats sans xéno (sans produits d'origine animale) capables de garantir la rentabilité, la reproductibilité et la sécurité sont nécessaires.
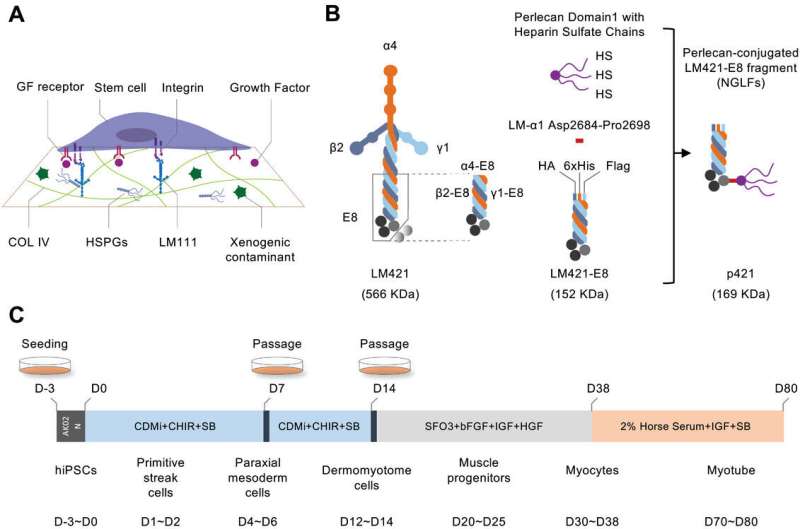
À cette fin, une équipe collaborative japonaise a combiné son expertise pour concevoir et valider une nouvelle protéine de matrice extracellulaire recombinante, appelée fragments de laminine de nouvelle génération (NGLF), permettant de différencier les cellules iPS en lignées de cellules musculaires.
Les résultats de cette étude ont été publiés dans Advanced Science le 29 avril 2024.
Des études antérieures ont établi des fragments de laminine E8 recombinante (LM-E8) comme substrat minimal pour les cultures de cellules iPS, mais ils ne soutiennent pas la différenciation myogénique. Pour identifier un variant LM-E8 capable de prendre en charge la génération de myocytes et de MuSC à partir de cellules iPS, l'équipe a testé diverses laminines avec différentes compositions, mais a constaté qu'elles ne supportaient que des niveaux considérablement inférieurs de différenciation myogénique.
Les chercheurs ont estimé que le perlecan, un noyau multifonctionnel de protéoglycane de sulfate d'héparane (HSPG) avec plusieurs chaînes de sulfate d'héparane dans Matrigel, pourrait être essentiel à sa capacité à prendre en charge diverses interactions moléculaires nécessaires au maintien et à la différenciation optimales des cellules iPS. Ils ont donc conçu un LM-E8 attaché. au domaine perlecan 1 avec trois chaînes HS (D1-HS).
Les chercheurs ont observé des améliorations significatives dans la différenciation myogénique en attachant cette modification aux extrémités C des variantes LM-E8. En particulier, l'isoforme p421 a montré la meilleure amélioration, encore meilleure que Matrigel, les chercheurs se sont donc concentrés sur l'utilisation de cette isoforme pour générer des myocytes et des MuSC.
En examinant les marqueurs de différenciation à différents stades (c'est-à-dire la strie primitive (PS), le mésoderme paraxial (PM) et le dermomyotome (DM)), l'équipe de recherche a confirmé que non seulement les NGLF sont supérieurs aux variantes LM-E8 correspondantes pour favoriser les stades spécifiques. expression du gène marqueur, p421 supporte systématiquement une meilleure différenciation que tous les autres NGLF testés.
Notamment, les chercheurs ont découvert que p421 soutenait spécifiquement la différenciation au stade PM, car aucun effet bénéfique n’avait été observé à partir de p421 après la formation de PM. De plus, en utilisant l'héparitinase (pour dégrader les chaînes HS) et le surfen (pour inhiber les interactions médiées par HS), ils ont déduit que les effets bénéfiques de p421 provenaient principalement du fragment HS.
De plus, en bloquant plusieurs récepteurs de signalisation et leurs effecteurs intracellulaires en aval, ils ont déterminé que p421 fonctionne principalement via la voie bFGF-FGFR-EGF pour favoriser l'induction des particules. L'analyse de l'expression génique a en outre indiqué que cette signalisation soutenait l'expression du gène HOX pour promouvoir les cellules iPS indifférenciées vers le stade PS.
Pour démontrer l'importance de l'orientation de conjugaison entre LM-E8 et D1-HS, les chercheurs ont généré des variantes de p421 en attachant le fragment HS à l'extrémité N-terminale de la chaîne β ou γ de LM-E8. Bien que ces variantes aient augmenté l'expression des gènes marqueurs spécifiques à un stade, p421 a montré des effets nettement plus forts en comparaison.
À partir de ces résultats, l'équipe de recherche a conclu que p421 facilite probablement la signalisation du FGFR en rapprochant les FGF liés au HS de la surface cellulaire pour favoriser la dimérisation du FGFR.
Enfin, pour illustrer comment p421 améliore la différenciation myogénique et surmonte les incohérences qui affectent les protocoles d'induction actuels, l'équipe de recherche a généré des lignées cellulaires iPS de contrôle et de maladie pour deux formes de dystrophie musculaire, la dystrophie musculaire de Duchene (DMD) et la myopathie de Miyoshi (MM).
Comme prévu, p421 a permis une différenciation myogénique considérablement améliorée par rapport à toutes les lignées cellulaires iPS examinées. De plus, les chercheurs ont découvert que p421 améliorait la différenciation myogénique dans plusieurs milieux de culture couramment utilisés.
En résumé, l'équipe de recherche a réussi à créer un substrat de protéoglycane recombinant qui prend en charge des améliorations significatives de la différenciation myogénique et a démontré son mécanisme sous-jacent.
On espère que les NGLF aideront à établir des protocoles de différenciation hautement efficaces et sans xéno pour générer des lignées de cellules musculaires dérivées de cellules iPS pour des applications médicales contre diverses myopathies.
Plus d'informations : Mingming Zhao et al, Les fragments de laminine-E8 conjugués à la chaîne d'héparane sulfate font progresser la différenciation mésodermique paraxiale suivie d'une induction myogénique élevée à partir des hiPSC, Science avancée (2024). DOI : 10.1002/advs.202308306
Informations sur le journal : Science avancée
Fourni par l'Université de Kyoto