Comprendre comment les cellules cancéreuses se propagent à partir d’une tumeur primitive est important pour plusieurs raisons, notamment pour déterminer l’agressivité de la maladie elle-même. Le mouvement des cellules vers la matrice extracellulaire (MEC) des tissus voisins est une étape essentielle dans la progression du cancer qui est directement corrélée à l'apparition des métastases.
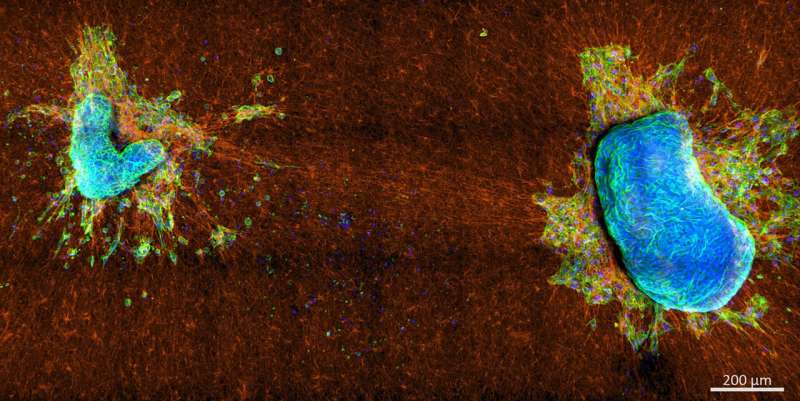
Dans une étude publiée dans APL Bioengineering une équipe de chercheurs d'Allemagne et d'Espagne a utilisé un panel de lignées cellulaires du cancer du sein et des explants de tumeurs primaires provenant de patientes atteintes d'un cancer du sein et du col de l'utérus pour examiner deux modes de contractilité cellulaire différents :l'un qui génère une tension superficielle collective des tissus qui maintient les amas de cellules compacts et un autre, plus directionnel. , contractilité qui permet aux cellules de se rétracter dans la MEC.
"Nous nous sommes concentrés sur deux paramètres, à savoir la capacité des cellules à tirer sur les fibres ECM et à générer des forces de traction et sur leur capacité à tirer les unes sur les autres, générant ainsi une tension superficielle tissulaire élevée", a déclaré l'auteur Eliane Blauth. "Nous avons lié chaque propriété à différents mécanismes contractiles et avons demandé comment elles étaient liées à la fuite des cellules cancéreuses et à l'agressivité des tumeurs."
L'équipe a découvert que les cellules plus agressives tirent plus fortement sur la MEC que sur elles-mêmes, tandis que les cellules non invasives tirent plus fortement sur elles-mêmes que sur la MEC, et que les différents comportements de traction sont attribués à différentes structures du cytosquelette d'actine à l'intérieur des cellules.
Les cellules invasives utilisent principalement des fibres de stress d'actine (des faisceaux d'actine épais qui traversent la cellule) pour générer des forces sur leur environnement, tandis que les cellules non invasives génèrent des forces à travers leur cortex d'actine, un mince réseau situé directement sous la membrane cellulaire.
L’étude a montré que ce n’est pas l’ampleur globale de ces modes de contractilité mais l’interaction entre eux qui détermine le potentiel de fuite d’une cellule. Des expériences avec des cellules modérément invasives ont démontré que la force totale que ces cellules génèrent sur les fibres de la MEC est comparable à celle des cellules non invasives, mais elles peuvent toujours se détacher et envahir la MEC, ce qui n'est pas possible pour les cellules non invasives.
"Les cellules non invasives ont toujours une contractilité corticale élevée, ce qui les maintient ensemble, tandis que les cellules modérément invasives ont une contractilité corticale qui disparaît presque", a déclaré Blauth. "Donc, peu de choses les retiennent même s'ils tirent beaucoup plus faiblement sur les fibres ECM."
Les mesures de l'équipe avec des explants de tumeurs vitales dérivées de patients ont confirmé les résultats des expériences sur les lignées cellulaires. Ici, le nombre de cellules présentant une contractilité corticale élevée a diminué au cours de la progression tumorale.
"Cela indique en outre que la capacité des cellules à tirer les unes sur les autres et à se maintenir groupées s'affaiblit à mesure que la tumeur se développe, augmentant potentiellement le risque de métastases."
Plus d'informations : Différents modes de contractilité contrôlent la fuite cellulaire des sphéroïdes multicellulaires et des explants tumoraux, APL Bioengineering (2024). DOI :10.1063/5.0188186
Informations sur le journal : Bio-ingénierie APL
Fourni par l'Institut américain de physique