L’extrait de vanille est l’un des composés aromatisants les plus utilisés dans les produits alimentaires et cosmétiques. L'odeur agréable et sucrée de cette saveur classique est conférée par le composé chimique « vanilline » présent dans les gousses des plants de vanille appartenant à la famille des orchidées. Chez les plantes, la vanilline est synthétisée par la conversion de l'acide férulique par l'enzyme VpVAN. Cependant, la biosynthèse en laboratoire de la vanilline à partir de VpVAN d'origine végétale ne produit que de très petites quantités de vanilline et est donc commercialement peu pratique.
De plus, bien que les essences de vanille d'origine chimique soient disponibles à bas prix, elles n'ont pas la saveur de l'extrait naturel de vanille, et la demande pour ce dernier reste élevée. De plus, les restrictions climatiques pour la culture des plants de vanille et le rendement relativement faible obtenu par plante ont conduit à une diminution de l'offre et à une flambée du prix de l'extrait naturel de vanille.
Pour relever ces défis, le professeur Toshiki Furuya du Département des sciences biologiques appliquées de la Faculté des sciences et technologies de l'Université des sciences de Tokyo et ses étudiants diplômés Shizuka Fujimaki et Satsuki Sakamoto ont développé avec succès une enzyme qui génère de la vanilline à partir d'acide férulique d'origine végétale.
"L'acide férulique, la matière première, est un composé qui peut être obtenu en abondance à partir de déchets agricoles tels que le son de riz et le son de blé. La vanilline est générée simplement en mélangeant l'acide férulique avec l'enzyme développée à température ambiante. Ainsi, la technologie établie peut fournissent une méthode simple et respectueuse de l'environnement pour produire des composés aromatiques », explique le professeur Furuya. Leur étude a été publiée le 10 mai 2024 dans Applied and Environmental Microbiology. .
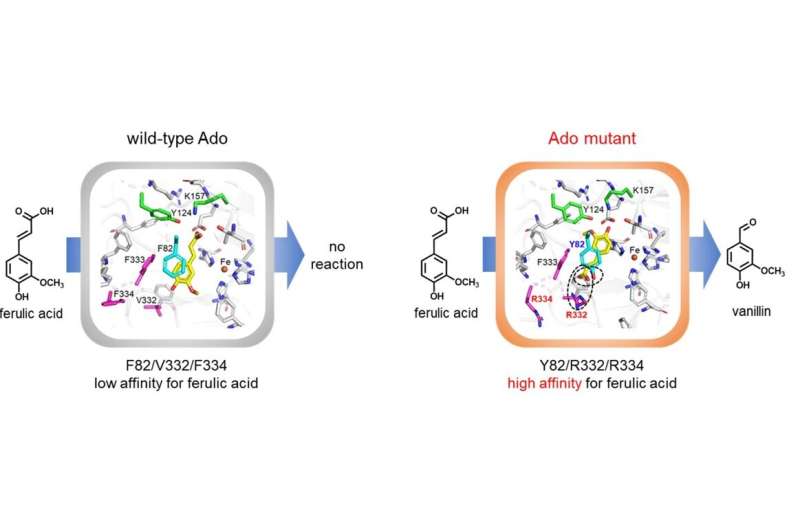
Les chercheurs ont utilisé des approches de génie génétique pour modifier la structure moléculaire d'une enzyme appelée « Ado ». L'Ado est à l'origine une enzyme oxydase qui ajoute un atome d'oxygène au substrat :l'isoeugénol.
À l’état natif, il n’a pas la capacité de convertir l’acide férulique en vanilline. Grâce à l'analyse de modélisation structurelle, les chercheurs ont pu prédire les modifications des acides aminés dans l'Ado, ce qui permettrait son interaction avec l'acide férulique.
Dans ce sens, ils ont mené une série d'expériences en remplaçant les résidus d'acides aminés phénylalanine et valine à des positions spécifiques dans la structure d'Ado, par divers autres acides aminés. Ils ont ensuite examiné la capacité de conversion de l'acide férulique des différentes protéines mutantes modifiées.
Après plusieurs essais et erreurs, ils ont découvert qu'une protéine mutante dans laquelle seuls trois résidus spécifiques de phénylalanine et de valine étaient remplacés par de la tyrosine et de l'arginine, réagissait de manière stable avec l'acide férulique et présentait une activité de conversion élevée. Notamment, l'enzyme modifiée ne nécessitait aucun cofacteur pour la conversion, contrairement à d'autres oxydases, et produisait de la vanilline à l'échelle du gramme par litre de solution réactionnelle, avec une efficacité catalytique et une affinité plus élevées que celles de l'enzyme de type sauvage.
La réaction nécessitait uniquement le mélange de l’enzyme, de l’acide férulique et de l’air (oxygène moléculaire), à température ambiante, ce qui en faisait un processus simple, durable et économiquement évolutif. En outre, l'enzyme moléculairement évoluée a également présenté une activité de conversion en acide p-coumarique et en acide sinapique, qui sont des composés obtenus à partir de la dégradation de la lignine, un déchet agricole courant.
Jusqu’à présent, aucune enzyme microbienne ou d’origine végétale n’a montré la capacité de convertir l’acide férulique en vanilline à l’échelle industrielle. Par conséquent, l'enzyme développée dans la présente étude montre un potentiel considérable pour permettre la production commerciale et économiquement viable de vanilline naturelle.
Expliquant les implications à long terme de leurs recherches, le professeur Furuya déclare :« Exploiter le potentiel des micro-organismes et des enzymes pour dériver des composés précieux dans des conditions douces à partir de ressources végétales renouvelables, offre une approche durable pour minimiser l'empreinte environnementale.
"Actuellement, en collaboration avec une entreprise, nos efforts de recherche se concentrent sur la mise en œuvre concrète de la production de vanilline grâce à l'utilisation de l'enzyme nouvellement développée."
Plus d'informations : Shizuka Fujimaki et al, Ingénierie d'une dioxygénase indépendante du coenzyme pour la production en une étape de vanilline à partir de l'acide férulique, Microbiologie appliquée et environnementale (2024). DOI :10.1128/aem.00233-24
Informations sur le journal : Microbiologie appliquée et environnementale
Fourni par l'Université des sciences de Tokyo