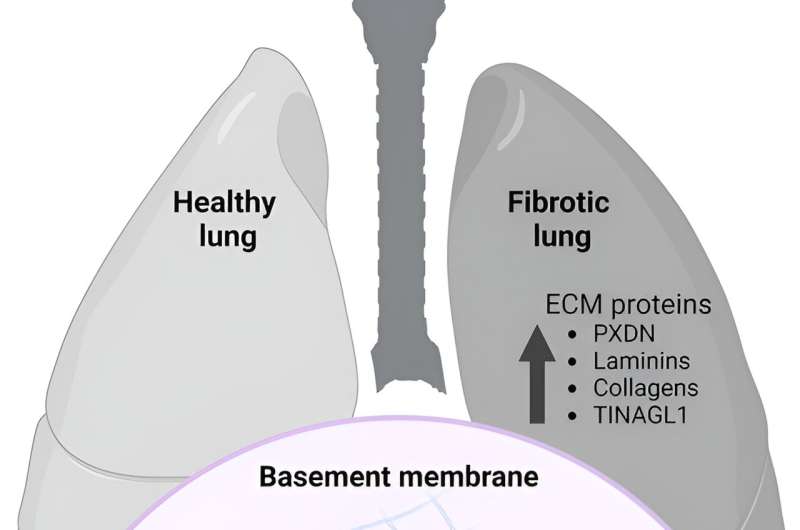
Des chercheurs du Centre de recherche sur les processus redox en biomédecine (Redoxome) au Brésil ont identifié des protéines de la matrice extracellulaire modifiées par l'action de l'acide hypobromeux dans les tissus pulmonaires normaux et fibreux, suggérant un rôle physiologique possible pour la bromation des protéines. Il s'agit de la première étude visant à identifier des protéines bromées dans la fibrose pulmonaire et le tissu pulmonaire non fibrotique.
La matrice extracellulaire est un réseau tridimensionnel complexe de protéines et d'autres macromolécules qui lient et ancrent les cellules pour former des tissus, remplissant des fonctions vitales de soutien cellulaire, de communications intercellulaires et de régulation du développement tissulaire.
L'étude est publiée dans la revue Redox Biology .
"Cette recherche a montré que la bromation se produit physiologiquement et que la peroxydasine, l'enzyme qui catalyse la formation d'acide hypobromeux, a d'autres cibles que le collagène, ce qui était l'une des questions les plus importantes dans ce domaine", a déclaré Litiele Cezar Cruz, premier auteur de l'étude. article. Elle a mené la recherche au cours de ses études postdoctorales sous la supervision de Flavia Meotti, professeur à l'IQ-USP et membre de Redoxome.
L'halogénation est une réaction chimique dans laquelle un ou plusieurs atomes d'halogène (principalement du fluor, du chlore, du brome ou de l'iode) sont ajoutés à un composé. Les modifications halogènes des molécules biologiques sont de plus en plus reconnues dans plusieurs domaines de la biologie, mais leur importance dans l'organisme des mammifères n'a pas été largement étudiée.
La découverte du rôle des ions bromure dans la réticulation oxydative du collagène IV au sein de la matrice extracellulaire a été la première preuve que le brome joue un rôle essentiel dans les organismes vivants.
"Nous en savons davantage sur la chloration, qui dépend de la myéloperoxydase, une enzyme inflammatoire. En général, ce type d'halogénation liée à une maladie est plus largement étudié car l'inflammation est à l'origine d'un grand nombre de maladies. Les maladies inflammatoires à activité myéloperoxydase ont tendance à impliquer une augmentation des protéines avec l'ajout de chlore.
"Cette modification par le brome est très similaire, car le chlore et le brome sont des éléments chimiques très similaires, et la modification se produit dans les mêmes acides aminés, y compris la tyrosine. Cependant, bien que les niveaux plasmatiques de brome soient mille fois inférieurs aux niveaux de chlore, le Ce dernier n'est pas un bon substrat pour la peroxydasine, et donc plus d'acide hypobromeux que d'acide hypochloreux est produit dans la matrice extracellulaire", a expliqué Meotti.
Cruz a entrepris d'étendre ces connaissances en étudiant la présence de protéines modifiées par la bromotyrosine dans des échantillons de tissu pulmonaire obtenus auprès d'humains en bonne santé et de patients atteints de fibrose pulmonaire idiopathique. Elle a également réanalysé les données publiées sur la protéomique des tissus pulmonaires. Dans les échantillons de tissus et les données protéomiques, elle a découvert des modifications dans plusieurs protéines de la membrane extracellulaire, même dans les poumons sains.
Plus d'informations : Litiele Cezar Cruz et al, Identification des protéines de la matrice extracellulaire bromée par la tyrosine dans les tissus pulmonaires normaux et fibrotiques, Biologie Redox (2024). DOI :10.1016/j.redox.2024.103102
Informations sur le journal : Biologie redox
Fourni par FAPESP