
Une communication efficace entre les cellules est vitale pour de nombreux processus biologiques, tels que le recrutement de cellules immunitaires pour combattre les maladies. La libération rapide d'au moins 80 molécules de signalisation, dont le facteur de nécrose tumorale et le facteur de croissance épidermique, est contrôlée par une protéase liée à la membrane appelée ADAM17.
Ce processus implique qu'ADAM17 clive (excréte) les molécules de signalisation de leurs formes précurseurs dans la membrane d'une cellule. La « pseudoprotéase » iRhom2 facilite la maturation et le transport d'ADAM17. Toutefois, le manque de connaissances structurelles a rendu flous les mécanismes qui sous-tendent ce processus.
Publié aujourd'hui dans Molecular Cell , des scientifiques du St. Jude Children's Research Hospital et de l'Université d'Oxford ont utilisé la cryomicroscopie électronique pour révéler une série de structures du complexe ADAM17/iRhom2 humain dans les états actif et inactif. Ces structures montrent qu'iRhom2 agit comme un gardien du cycle de vie de l'ADAM17, interagissant avec les régions clés de l'ADAM17 qui contrôlent son activité.
Ces travaux offrent également des pistes potentielles pour la conception de médicaments destinés à lutter contre les maladies inflammatoires chroniques et la dérégulation auto-immune. "Nous pensons qu'il est possible de concevoir de petites molécules qui ciblent directement iRhom2 au lieu d'ADAM17, ou l'interface entre iRhom2 et ADAM17", a déclaré l'auteur co-correspondant, Chia-Hsueh Lee, Ph.D., Département de biologie structurale de St. Jude. .
iRhom2 est une pseudoprotéase :elle possède toutes les caractéristiques structurelles d'une protéase de la famille des losanges, sauf qu'elle n'a pas la capacité de définir la protéase pour cliver les protéines. Cependant, comme un vieux chien apprenant de nouveaux tours, iRhom2 joue de nouveaux rôles dans l'échafaudage et le transport d'ADAM17.
Comme l'ont révélé des études structurelles, l'impact d'iRhom2 sur la fonction ADAM17 commence lors de la synthèse initiale des deux protéines. "Le réticulum endoplasmique est l'endroit où ADAM17 et iRhom2 sont fabriqués et, à ce stade, ils forment un complexe", a expliqué Lee. iRhom2 facilite ensuite le transfert d'ADAM17 vers l'appareil de Golgi pour la maturation, où le concept précédent d'iRhom2 servant simplement de « échafaudage passif » a été mis à l'épreuve par les structures de Lee.
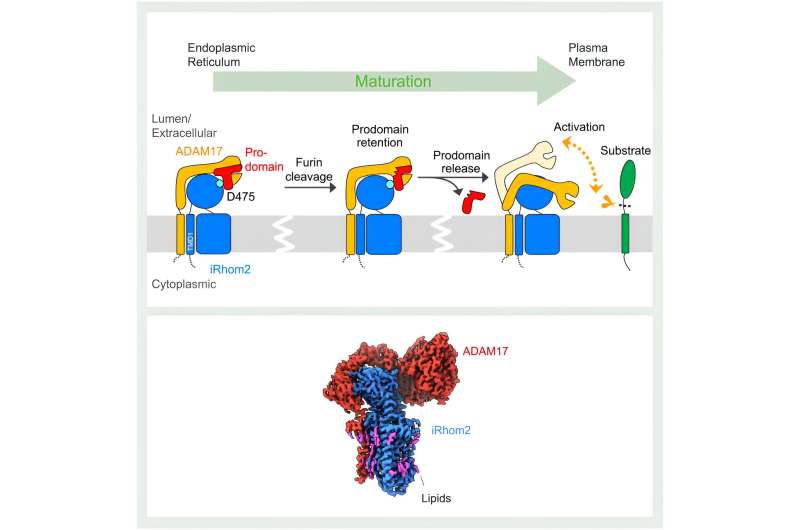
L'interaction entre iRhom2 et ADAM17 était présumée se produire exclusivement entre les domaines transmembranaires des protéines, qui fixent les protéines à la membrane cellulaire. À la surprise des chercheurs, les deux protéines interagissent également via leurs régions extracellulaires. Grâce à ces interactions, iRhom2 conserve une région importante d’ADAM17 appelée prodomaine. Le prodomain est une région qui fait office de goupille de sécurité sur un extincteur.
"ADAM17 lui-même est auto-inhibé. Il possède un plafond de prodomaine pour bloquer son propre site de protéase", a expliqué Lee.
Au sein de l'appareil de Golgi, cette coiffe de prodomaine autorégulatrice est clivée. Cependant, iRhom2 conserve la coiffe ADAM17 jusqu'à ce que le complexe atteigne la membrane cellulaire. Cette étape est cruciale pour éviter l’activation prématurée d’ADAM17. Les nouvelles structures révèlent qu’une fois le capuchon retiré, ADAM17 est activé. Cette activation est marquée par un gain significatif en flexibilité, qui permet à ADAM17 de rechercher des substrats dans son espace environnant.
Il a été démontré que ADAM17 joue un rôle dans le développement et la progression de plusieurs types de cancer ; cependant, la famille de protéines ADAM est bien conservée. Un médicament qui cible ADAM17 peut entraîner des effets hors cible. Lee est optimiste quant au fait que ces structures peuvent offrir un modèle d'ingéniosité en matière de conception de médicaments.
"Sur la base de notre modèle, si nous pouvions maintenir ces deux protéines ensemble, par exemple grâce à un liant qui améliore l'interaction entre iRhom2 et ADAM17, alors iRhom2 ne libérerait pas le capuchon du prodomaine", a déclaré Lee. "Cela réduira considérablement l'activité de l'ADAM17."
Les premiers auteurs de l'étude sont Fangfang Lu, Université d'Oxford et Hongtu Zhao, St. Jude. Les autres auteurs co-correspondants de l'étude sont Hongtu Zhao, St. Jude et Matthew Freeman, de l'Université d'Oxford. Les autres auteurs de l'étude sont Yaxin Dai et Yingdi Wang, St. Jude.
Plus d'informations : Fangfang Lu et al, Cryo-EM révèlent qu'iRhom2 restreint l'activité de la protéase ADAM17 pour contrôler la libération du facteur de croissance et des signaux inflammatoires, Molecular Cell (2024). DOI :10.1016/j.molcel.2024.04.025
Informations sur le journal : Cellule moléculaire
Fourni par l'hôpital de recherche pour enfants St. Jude