La division cellulaire produit de nouvelles cellules, qui soutiennent la prolifération et le développement de la vie. La mitose est la phase la plus courte et la plus dynamique du cycle cellulaire. Pendant la mitose, les chromosomes sont répartis uniformément entre les deux cellules filles, préservant ainsi l'intégrité du génome.
Le centromère, une région spécialisée du chromosome, sert de plateforme de recrutement pour diverses protéines essentielles au maintien de la cohésion des chromatides sœurs et à l'assemblage des kinétochores. Ces kinétochores sont responsables de la fixation des microtubules du fuseau, qui permettent la congression des chromosomes et une ségrégation appropriée pendant la division cellulaire.
Des défauts dans la structure ou la fonction du centromère peuvent entraîner une mauvaise ségrégation des chromosomes, ce qui peut à son tour entraîner une instabilité génomique.
Bub1 (Budding Uninhibited by Benzimidazole 1) est une sérine/thréonine kinase qui remplit diverses fonctions pendant la mitose. Il est recruté dans les kinétochores non attachés pendant la prométaphase et favorise le recrutement d'autres protéines en aval dans les kinétochores et les centromères.
L'acétylation des protéines est une modification post-traductionnelle conservée qui existe à la fois chez les procaryotes et les eucaryotes. En 1964, des chercheurs ont découvert pour la première fois l’acétylation des histones. Des études ultérieures ont révélé que non seulement les histones, mais également de nombreuses protéines non histones sont sujettes à des modifications d'acétylation, impliquées dans la régulation de diverses activités de la vie cellulaire.
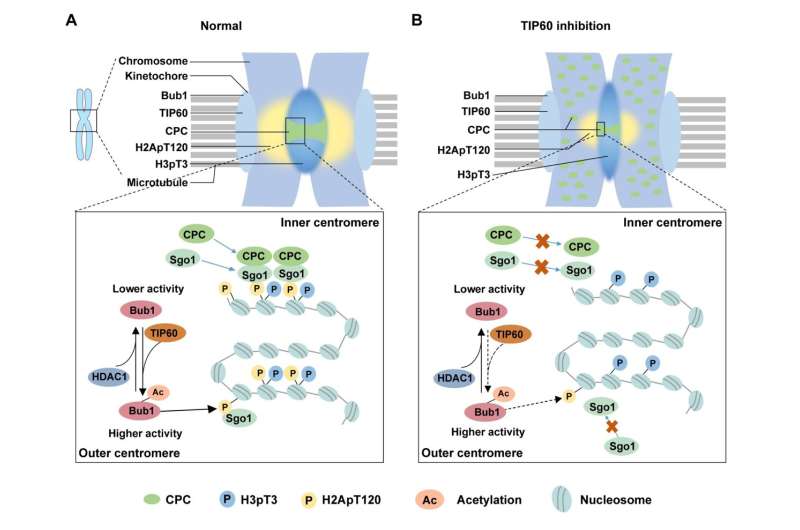
Le professeur Chuanmao Zhang et ses collègues de l'Université des sciences et technologies de Kunming et de l'Université de Pékin ont découvert un mécanisme moléculaire qui régule la congression et la ségrégation des chromosomes. Les chercheurs ont montré dans leur article publié dans Science China Life Sciences , TIP60 acétyle Bub1 en K424 et K431 sur les kinétochores au début de la mitose, ce qui améliore l'activité kinase de Bub1.
"Lorsque nous avons enrichi les protéines acétylées mitotiques, nous avons détecté Bub1 parmi elles", a déclaré Mengjie Sun, le premier auteur de l'article. "De plus, nous avons observé une augmentation significative du niveau d'acétylation de Bub1 au début de la mitose. Cela suggère que l'acétylation de Bub1 pourrait avoir un rôle à jouer dans le processus."
C'est le début de leurs recherches. Et puis, grâce à une série d’expériences, qui incluent l’imagerie de cellules vivantes et des techniques biochimiques, ils ont découvert que l’acétylation de Bub1 est essentielle à la congression et à la ségrégation correctes des chromosomes. Une acétylation altérée de Bub1 entraîne un retard significatif dans l'alignement des chromosomes et des défauts dans la ségrégation des chromosomes, notamment des chromosomes en retard et la formation de ponts anaphases.
Ensuite, grâce à des expériences in vivo et in vitro, ils ont déterminé que l'acétyltransférase TIP60 est responsable de l'acétylation de Bub1.
En outre, les chercheurs ont étudié comment l’acétylation de Bub1, médiée par TIP60, régule la congression et la ségrégation des chromosomes. Ils ont détecté l'impact sur le recrutement des protéines en aval dans les centromères et ont découvert que les composants CPC et Sgo1 ne pouvaient pas être efficacement recrutés dans les centromères lorsque l'acétylation de Bub1 était perturbée.
Des études antérieures ont rapporté que Bub1 phosphoryle H2A à T120 (H2ApT120) pour recruter CPC et Sgo1. Les chercheurs ont ensuite cherché à déterminer comment l’acétylation de Bub1 affecte le niveau de H2ApT120. Comme ils s'y attendaient, l'acétylation de Bub1 améliore son activité kinase, favorisant ainsi la phosphorylation de H2A.
"C'est le mécanisme par lequel l'acétylation de Bub1 régule la congression et la ségrégation des chromosomes", a conclu le professeur Zhang.
Étant donné que l’acétylation de Bub1 est un processus dynamique tout au long du cycle cellulaire, ils visaient également à identifier l’enzyme responsable de la désacétylation de Bub1. Ils ont identifié une désacétylase essentielle, HDAC1, qui intervient dans la désacétylation de Bub1 lorsque les cellules quittent la mitose. Une désacétylation prématurée de Bub1 par HDAC1 peut altérer l'activité kinase de Bub1 et conduire à un désassemblage anormal des centromères et à une mauvaise ségrégation des chromosomes.
"Cela forme un cycle d'acétylation et de désacétylation de Bub1 dans le cycle cellulaire", a expliqué le Dr Biying Yang.
Plus d'informations : Mengjie Sun et al, L'acétylation TIP60 de Bub1 régule la phosphorylation centromérique de H2AT120 pour une ségrégation fidèle des chromosomes, Science China Life Sciences (2024). DOI :10.1007/s11427-023-2604-8
Informations sur le journal : Science Chine Sciences de la vie
Fourni par Science China Press