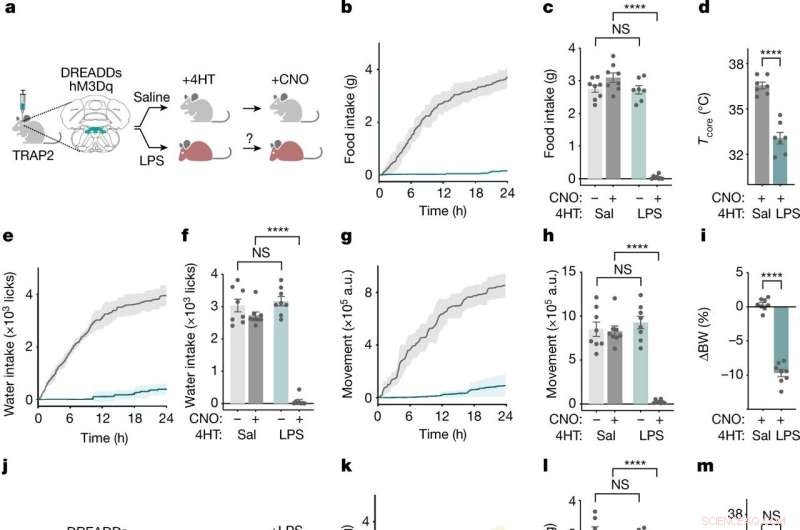
Les neurones NTS-AP régulent le comportement de la maladie. un , Méthode de marquage TRAP2 et de réactivation des neurones NTS – AP à l'aide de DREADD hM3Dq (Gq) activants. Souris grise, normale; souris rouge, malade. b ,e ,g , Apport alimentaire cumulé (b ), prise d'eau (e ) et mouvement (g ) pendant 24 h après la réactivation des neurones marqués au sérum physiologique (gris) et marqués au LPS (cyan). c ,f ,h , Apport alimentaire (c ) (ANOVA P < 1 × 10 −7 ), prise d'eau (f ) (ANOVA P < 1 × 10 −7 ) et mouvement (h ) (ANOVA P < 1 × 10 −7 ) à 12 h après l'injection de CNO pour la réactivation des neurones marqués au sérum physiologique (gris foncé) et marqués au LPS (cyan foncé) ; des contrôles salins pour l'administration de CNO sont également affichés (gris clair; cyan clair). d ,je , Modification de la température à cœur (t non apparié -tester P = 4,6 × 10 −6 ) 4 h après la réactivation (d ) et pourcentage de poids corporel (t non apparié -tester P < 1 × 10 −7 ) 24 h après la réactivation (i ) de neurones marqués au sérum physiologique (gris) et marqués au LPS (cyan). Dans tous les panels, animaux marqués au sérum physiologique, n = 8 ; Animaux marqués au LPS, n = 7. j , Schéma du marquage et de l'inactivation de TRAP2 à l'aide de DREADD hM4Di (Gi) inhibiteurs lors d'une exposition simultanée au LPS. k ,n ,p , Apport alimentaire cumulé (k ), consommation d'eau (n ) et mouvement (p ) pendant 24 h après inhibition à base de CNO et traitement LPS simultané (0,5 mg kg −1 , i.p.) de neurones marqués au sérum physiologique (gris) et marqués au LPS (jaune foncé). Traitement salin des neurones marqués au LPS (jaune clair) indiqué à titre de référence. l ,o ,q , Apport alimentaire (l ) (ANOVA P = 2,9 × 10 −7 ), consommation d'eau (o ) (ANOVA P = 2.1 × 10 −7 ) et mouvement (g ) (ANOVA P = 3,3 × 10 −4 ) à 12 h après inhibition et traitement LPS simultané (0,5 mg kg −1 , i.p.) de neurones marqués au sérum physiologique (gris foncé) et marqués au LPS (jaune foncé); des contrôles salins pour l'administration de CNO sont également affichés (gris clair; jaune clair). m ,r , Modification de la température à cœur (t non apparié -test, NS) 4 h après (m ) et pourcentage de poids corporel (t non apparié -tester, P = 3,2 × 10 −5 ) 24 h après (r ) inhibition et traitement LPS simultané des neurones marqués au sérum physiologique (gris) et marqués au LPS (jaune). Dans tous les panels, animaux marqués au sérum physiologique, n = 7 ; Animaux marqués au LPS, n = 7. ***P <0,001, **P <0,0001 et NS, non significatif (P> 0,05). Toutes les barres d'erreur représentent s.e.m. Crédit :Nature (2022). DOI :10.1038/s41586-022-05161-7
Nous avons tendance à moins manger, boire et bouger lorsque nous ne nous sentons pas bien. Et nous ne sommes pas seuls - la plupart des animaux réduisent ces mêmes trois comportements lorsqu'ils combattent une infection.
Maintenant, une nouvelle étude identifie le groupe de neurones qui contrôlent ces réponses, appelées comportements de maladie. En provoquant des réponses immunitaires chez la souris, les chercheurs ont démontré qu'une population spécifique de cellules du tronc cérébral induisait puissamment trois comportements pathologiques révélateurs. De plus, l'inhibition de ces neurones émousse chacun de ces éléments comportementaux de la réponse à la maladie. Les résultats, publiés dans Nature , relient directement l'inflammation aux voies neuronales régulant le comportement, offrant un aperçu de la façon dont le système immunitaire interagit avec le cerveau.
"Nous en sommes encore aux premiers jours d'essayer de comprendre le rôle du cerveau dans l'infection", déclare Jeffrey M. Friedman, professeur Marilyn M. Simpson à l'Université Rockefeller. "Mais avec ces résultats, nous avons maintenant une occasion unique de nous demander :à quoi ressemble votre cerveau lorsque vous êtes malade ?"
Il a été démontré que les comportements de maladie jouent un rôle important dans la guérison d'un animal après une infection. Des études antérieures ont renforcé cette théorie en démontrant que les animaux forcés de manger lorsqu'ils sont malades présentaient une mortalité considérablement accrue. "Ces changements de comportement pendant l'infection sont vraiment importants pour la survie", déclare l'auteur principal Anoj Ilanges, ancien étudiant diplômé du laboratoire de Friedman, aujourd'hui chef de groupe au HHMI Janelia Research Campus
Mais il n'a jamais été clair comment le cerveau coordonne cette envie quasi universelle de refuser les repas et de se recroqueviller sous les couvertures avec le début de l'infection. Friedman et Ilanges ont donc entrepris de cartographier les régions cérébrales à l'origine des comportements pathologiques chez la souris.
L'équipe a commencé par exposer des souris au LPS, un morceau de paroi cellulaire bactérienne qui active le système immunitaire et induit puissamment un comportement pathologique. Peu de temps après une injection de LPS, il y a eu un pic d'activité dans une région du tronc cérébral connue sous le nom de complexe vagal dorsal, parmi une population de neurones exprimant le neuropeptide ADCYAP1. Pour confirmer qu'ils avaient trouvé les bonnes cellules cérébrales, les chercheurs ont ensuite activé ces neurones chez des souris en bonne santé et ils ont découvert que les animaux mangeaient, buvaient et se déplaçaient moins. En revanche, lorsque les neurones ADCYAP1 étaient désactivés, l'effet du LPS sur ces comportements était significativement réduit.
"Nous ne savions pas si des neurones identiques ou différents régulaient chacun de ces comportements", explique Friedman. "Nous avons trouvé surprenant qu'une seule population neuronale semble réguler chacun de ces composants de la réponse à la maladie."
Les auteurs n'étaient cependant pas tout à fait surpris que cette région du tronc cérébral soit impliquée dans la médiation des comportements de maladie. Le complexe vagal dorsal est l'un des rares carrefours physiologiques précieux du système nerveux central, où l'absence de barrière hémato-encéphalique permet aux facteurs circulants dans le sang de transmettre les informations directement au cerveau. "Cette région est devenue une sorte de centre d'alerte pour le cerveau, transmettant des informations sur les substances aversives ou nocives qui, le plus souvent, réduisent l'apport alimentaire", explique Friedman.
Dans les mois à venir, l'équipe de Friedman à Rockefeller a l'intention d'intégrer ces découvertes dans leur objectif global de comprendre les signaux physiologiques et les circuits neuronaux qui régulent le comportement alimentaire. Ils sont particulièrement intéressés à comprendre pourquoi même les souris conçues pour manger avec voracité cesseront néanmoins de manger lorsqu'elles sont exposées à des infections bactériennes.
Pendant ce temps, Ilanges prévoit d'étudier le rôle que jouent d'autres régions du cerveau en réponse aux infections, élargissant ainsi nos connaissances sur le rôle du cerveau au cours de ce processus critique. "Nous avons examiné une région du cerveau, mais il y en a beaucoup d'autres qui s'activent avec la réponse immunitaire", dit-il. "Cela ouvre la porte à la question de savoir ce que fait le cerveau, de manière holistique, pendant l'infection." Neurones du tronc cérébral qui régulent les symptômes de la maladie trouvés dans le modèle de souris