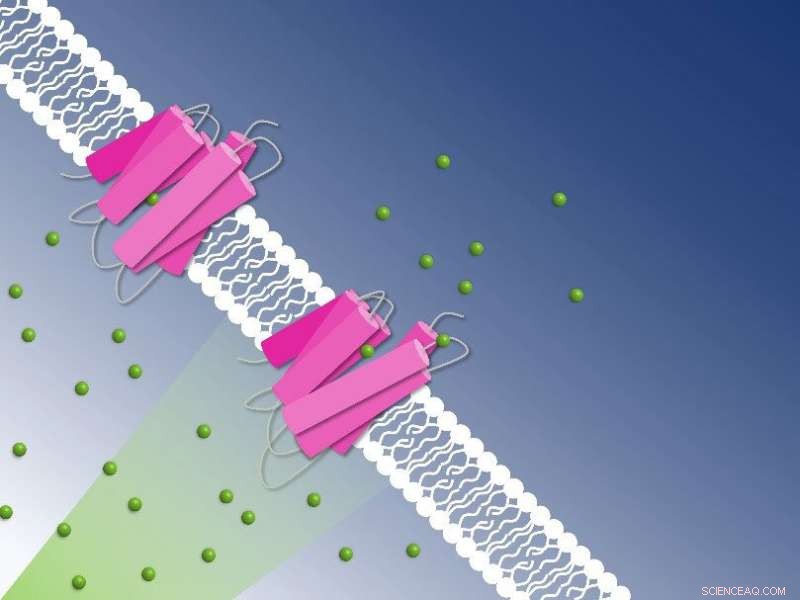
Chlorure photoactif pompant à travers la membrane cellulaire capturé par cristallographie en série résolue en temps :les ions chlorure (sphères vertes) sont transportés à travers la membrane cellulaire par la pompe à chlorure NmHR (rose). Crédit :Guillaume Gotthard et Sandra Mous
De nombreuses bactéries et algues unicellulaires ont des pompes actionnées par la lumière dans leurs membranes cellulaires :des protéines qui changent de forme lorsqu'elles sont exposées à des photons de sorte qu'elles peuvent transporter des atomes chargés dans ou hors de la cellule. Grâce à ces pompes, leurs propriétaires unicellulaires peuvent s'adapter au pH ou à la salinité de l'environnement.
L'une de ces bactéries est Nonlabens marinus, découverte pour la première fois en 2012 dans l'océan Pacifique. Entre autres, il possède une protéine rhodopsine dans sa membrane cellulaire qui transporte les anions chlorure de l'extérieur de la cellule vers son intérieur. Tout comme dans l'œil humain, une molécule rétinienne liée à la protéine s'isomérise lorsqu'elle est exposée à la lumière. Cette isomérisation démarre le processus de pompage. Les chercheurs ont maintenant obtenu des informations détaillées sur le fonctionnement de la pompe à chlorure de Nonlabens marinus.
L'étude a été dirigée par Przemyslaw Nogly, autrefois postdoctorant au PSI et maintenant Ambizione Fellow et chef de groupe à l'ETH Zürich. Avec son équipe, il a combiné des expériences dans deux des grandes installations de recherche du PSI, la source de lumière suisse SLS et le laser à rayons X à électrons libres SwissFEL. Des dynamiques plus lentes de l'ordre de la milliseconde ont été étudiées via une cristallographie en série à résolution temporelle au SLS, tandis que des événements plus rapides, jusqu'à la picoseconde, ont été capturés au SwissFEL, puis les deux ensembles de données ont été rassemblés.
"Dans un article, nous exploitons les avantages de deux installations de pointe pour raconter toute l'histoire de cette pompe à chlorure", déclare Nogly. Jörg Standfuss, co-auteur de l'étude qui a constitué une équipe du PSI dédiée à la création de tels films moléculaires, ajoute que "cette combinaison permet une recherche biologique de premier ordre comme cela ne serait possible que dans très peu d'autres endroits dans le monde à côté du PSI".

Les cristaux roses révèlent le mécanisme de transport du chlorure sur la membrane cellulaire :en utilisant la cristallographie en série résolue dans le temps, les cristaux roses de NmHR ont révélé des sites de liaison d'ions dans le transporteur de chlorure et la dynamique de pompage après la photoactivation. Cela a permis aux chercheurs de déchiffrer le mécanisme de transport du chlorure. Crédit :Sandra Mous
Pas de retour
Comme l'étude l'a révélé, l'anion chlorure est attiré par un patch chargé positivement de la protéine rhodopsine dans la membrane cellulaire de Nonlabens marinus. Ici, l'anion pénètre dans la protéine et se lie finalement à une charge positive au niveau de la molécule rétinienne à l'intérieur. Lorsque la rétine s'isomérise en raison de l'exposition à la lumière et se retourne, elle entraîne l'anion chlorure et le transporte ainsi un peu plus loin à l'intérieur de la protéine. "C'est ainsi que l'énergie lumineuse est directement convertie en énergie cinétique, déclenchant la toute première étape du transport des ions", explique Sandra Mous, titulaire d'un doctorat. étudiant dans le groupe de Nogly et premier auteur de l'article.
Étant maintenant de l'autre côté de la molécule rétinienne, l'ion chlorure a atteint un point de non-retour. De là, il ne va que plus loin à l'intérieur de la cellule. Une hélice d'acides aminés se détend également lorsque le chlorure se déplace, obstruant en outre le passage vers l'extérieur. "Pendant le transport, deux portes moléculaires s'assurent ainsi que le chlorure ne se déplace que dans une seule direction :à l'intérieur", explique Nogly. Un processus de pompage au total prend environ 100 millisecondes.
Il y a deux ans, Jörg Standfuss, Przemyslaw Nogly et leur équipe ont dévoilé le mécanisme d'une autre pompe bactérienne alimentée par la lumière :la pompe à sodium de Krokinobacter eikastus. Les chercheurs sont impatients de découvrir les détails des pompes à lumière car ces protéines sont de précieux outils optogénétiques :génétiquement modifiées dans des neurones de mammifères, elles permettent de contrôler les activités des neurones par la lumière et ainsi de rechercher leur fonction.