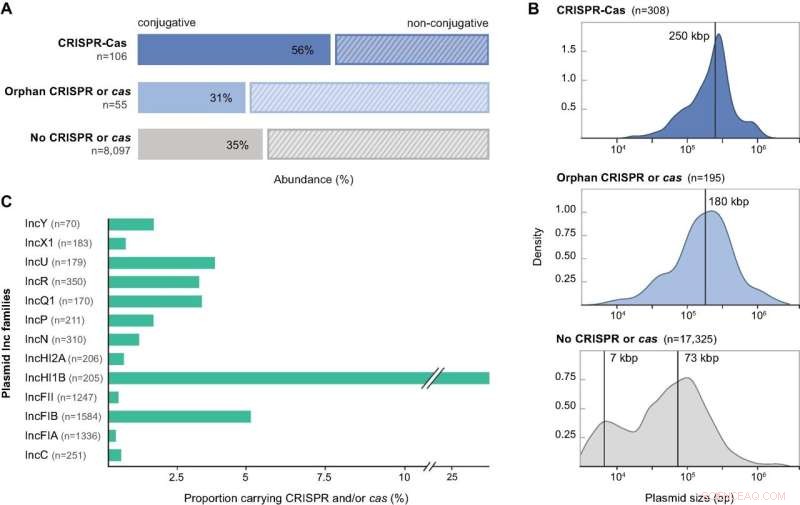
Caractéristiques des plasmides codant pour les composants CRISPR-Cas. (A) Prédictions de mobilité pour la collection de plasmides protéobactériens non redondants analysés dans cette étude, présentés en fonction de leur contenu CRISPR-Cas :locus CRISPR-Cas complets, CRISPR orphelins ou cas, et aucun CRISPR ou cas. (B) Distributions de taille pour la collection de génomes plasmidiques portant des locus CRISPR-Cas complets, des matrices orphelines, des opérons cas solo et aucun gène CRISPR ou cas. Les lignes verticales indiquent la taille médiane du plasmide pour les distributions unimodales et les moyennes estimées à partir d'un modèle de mélange gaussien à 2 composants pour la distribution bimodale. Les densités sont calculées avec les paramètres par défaut dans la base R. (C) Distribution des groupes d'incompatibilité plasmidique dans la fraction typable Inc de l'ensemble de données plasmidique complet et abondance relative du sous-ensemble codant pour les locus CRISPR-Cas. Des plasmides uniques peuvent appartenir à plus d'un groupe Inc. Seuls les groupes Inc contenant plus de 10 plasmides sont représentés. Crédit :Recherche sur les acides nucléiques DOI :10.1093/nar/gkab859
CRISPR-Cas est devenu une sorte de superstar au cours de la dernière décennie en tant qu'outil d'édition de gènes au potentiel révolutionnaire, en particulier dans les sciences de la santé. Connu à l'origine comme une défense immunitaire chez les bactéries, le CRISPR-Cas naturel s'est avéré plus diversifié et polyvalent que ne le pensaient les chercheurs scientifiques. Maintenant, un groupe de chercheurs du département de biologie de l'Université de Copenhague a étudié la prévalence des systèmes CRISPR-Cas dans les plasmides.
Les chercheurs ont examiné plus de 30 000 génomes plasmidiques complets et ont trouvé CRISPR-Cas dans environ 3 % d'entre eux, une proportion élevée même par rapport aux bactéries. Ils ont également trouvé divers représentants de pas moins de cinq des six types connus de CRISPR-Cas dans les génomes plasmidiques étudiés. Les résultats démontrent que les systèmes CRISPR-Cas sont à la fois répandus et diversifiés dans les plasmides et, fait intéressant, que la grande majorité d'entre eux ciblent d'autres plasmides.
"En partie, c'est excitant parce que cela soutient une compréhension plus récente des plasmides comme ayant un degré plus élevé d'autonomie par rapport à leurs cellules hôtes, généralement des bactéries. Mais aussi, parce qu'à long terme, cela peut ouvrir des voies pour combattre la virulence et la résistance. dans les bactéries, que les plasmides aident à propager", explique Rafael Pinilla-Redondo, l'un des principaux chercheurs de l'étude et basé au département de biologie de l'université de Copenhague.
CRISPR agit comme un GPS génomique, où une mémoire stockée de fragments d'ADN étrangers peut être utilisée pour localiser une cible pour les protéines Cas, les "ciseaux génétiques". Dans la majorité des résultats de l'étude, c'est l'ADN d'autres plasmides qui a été découvert dans la mémoire immunitaire des systèmes CRISPR-Cas, c'est-à-dire placé dans le réticule.
Partie d'un changement de paradigme
Selon les chercheurs, cela suggère une lutte pour les ressources entre les plasmides, où les plasmides servent leurs propres intérêts en travaillant activement pour empêcher d'autres plasmides d'accéder à la bactérie hôte dans laquelle ils résident. Dans cette bataille, ils utilisent CRISPR comme arme.
Les chercheurs ont eu l'occasion d'examiner simultanément les bactéries hôtes de l'ensemble de données de plasmide de plus de 30 000 pour les mêmes séquences CRISPR-Cas. L'idée était d'étudier si les séquences trouvées dans les plasmides reflétaient le contenu CRISPR dans les cellules hôtes, mais ce n'était généralement pas le cas.
"Nos résultats suggèrent que les plasmides ont un degré élevé d'autonomie par rapport aux bactéries dans lesquelles ils vivent. Alors que les plasmides dépendent de leur hôte, ce sont aussi des entités génétiquement indépendantes qui servent leurs propres intérêts. Leur contenu CRISPR-Cas différent est un excellent exemple de cette autonomie », déclare Rafael Pinilla-Redondo.
Les nouveaux résultats de la recherche contribueront à ce que les chercheurs considèrent comme un changement de paradigme en microbiologie. En microbiologie, le flux de gènes ou le transfert de gènes fait référence au moment où le matériel génétique se déplace entre les cellules, par l'intermédiaire d'éléments génétiques mobiles. Alors que certains éléments génétiques mobiles sont autorisés à s'infiltrer, au profit d'une cellule, d'autres sont stoppés car nuisibles. La compréhension commune a longtemps été que les bactéries contrôlent le flux de gènes.
Le changement de paradigme permet de comprendre où les bactéries jouent en réalité un rôle beaucoup moins important en influençant le flux génétique.
"Ce que l'on supposait autrefois être des bactéries luttant pour se protéger des parasites génétiques, comme les virus et les plasmides, est beaucoup plus complexe. Peut-être faudrait-il mieux comprendre que les parasites se battent entre eux, par exemple, pour savoir lesquels devraient être autorisés à vivre derrière l'oreille d'une vache », explique Rafael Pinilla-Redondo.
La possibilité de nouvelles armes contre la résistance aux antibiotiques
Les nouvelles connaissances sur la façon dont les plasmides utilisent CRISPR pourraient avoir un impact sur la façon dont nous combattrons les bactéries dangereuses à l'avenir. Les plasmides sont essentiels à la propagation de gènes nocifs entre les bactéries par le biais de ce que l'on appelle le transfert horizontal de gènes.
La prolifération du matériel génétique est cruciale pour la capacité des bactéries à s'adapter à de nouveaux environnements et défis. À partir d'une bactérie résistante aux antibiotiques, un plasmide peut se copier et transférer cette propriété aux bactéries environnantes dans le cadre de son propre ADN.
Ainsi, les batailles entre plasmides peuvent également aider les chercheurs à en savoir plus sur la façon de les combattre.
"En comprenant comment les plasmides se font concurrence, nous pourrons peut-être apprendre à les ralentir et ainsi ralentir la propagation de la résistance aux antibiotiques et des propriétés virulentes et nocives entre les bactéries", déclare Søren Johannes Sørensen, professeur de microbiologie et co-auteur de l'article de recherche.
"A long terme, il est possible que nous puissions nous approprier les stratégies des plasmides et les utiliser comme des outils. Sans emprunter à la nature, nous serions assez limités. Mais si nous pouvons apprendre les forces et les faiblesses de la plasmides d'eux-mêmes, des opportunités se présenteront », dit-il.
Que signifie CRISPR-Cas ?
Les fragments d'ADN (CRISPR) et les ciseaux à protéines Cas (par exemple, Cas9) peuvent localiser des séquences d'ADN spécifiques et les couper.
Il est prévu que CRISPR-Cas jouera un rôle révolutionnaire en tant qu'outil d'édition de gènes, notamment dans les sciences de la santé, pour le traitement des troubles génétiques, entre autres.
Les systèmes CRISPR étaient à l'origine considérés comme un système immunitaire contre les bactéries, en particulier contre les virus. Cependant, de nombreux chercheurs considèrent désormais CRISPR-Cas comme un outil "Guns for Hire" qui peut être déployé à une multitude de fins, par de nombreux acteurs différents, y compris les bactéries, les plasmides et les humains.
Qu'est-ce qu'un plasmide ?
Un plasmide est une petite molécule d'ADN en forme d'anneau, un élément génétique dit mobile, présent dans les bactéries et certains autres types de micro-organismes.
Cela rappelle les virus, car tous deux sont des parasites à l'intérieur des cellules. Les plasmides peuvent se reproduire indépendamment de la cellule hôte et offrent souvent des avantages à la cellule hôte.
Entre autres choses, ils peuvent donner ou transférer des propriétés génétiques à une bactérie, par exemple en la rendant résistante aux antibiotiques ou pathogène, dans un processus connu sous le nom de transfert horizontal de gènes.
Les plasmides sont depuis longtemps un outil important en biologie moléculaire pour, entre autres, le clonage de gènes et l'introduction de matériel génétique dans les cellules bactériennes.
Qu'est-ce que le transfert horizontal de gènes ?
Le transfert horizontal de gènes se produit lorsqu'un organisme transfère des gènes à un autre organisme qui n'est pas sa propre progéniture.
Dans une large mesure, la capacité des bactéries à s'adapter à de nouveaux environnements et défis dépend de l'apport de nouveaux gènes de cette manière.
Le phénomène est responsable de la crise imminente de la résistance aux antibiotiques, car les bactéries développent rapidement une résistance aux antibiotiques en acquérant des gènes résistants. Elle est très souvent médiée par les plasmides, faisant de la prolifération des plasmides un problème mondial de santé publique.
À propos de l'étude :les chercheurs ont créé un scanner CRISPR
Pour étudier la prévalence de CRISPR-Cas dans les plasmides, les chercheurs ont utilisé la plus grande collection de génomes de plasmides entièrement séquencés, un ensemble de données compilé par des chercheurs du monde entier.
Pour gérer les grandes quantités de données, les chercheurs du Département de biologie ont développé un logiciel pour rechercher les pièces CRISPR connues. Le programme, nommé CRISPRCasTyper, a depuis été mis gratuitement à la disposition d'autres chercheurs. Les humains ne sont pas les premiers à réutiliser CRISPR