Crédit :Université de Cologne
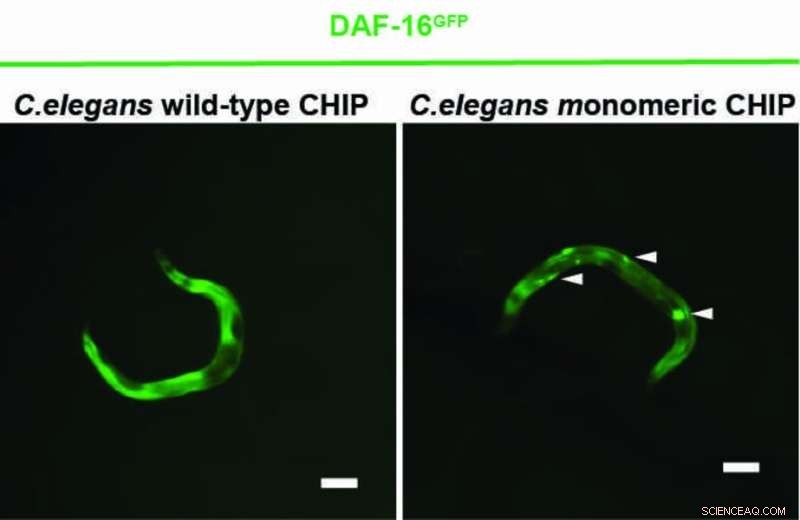
Une nouvelle étude montre que la protéine CHIP peut réguler le récepteur de l'insuline plus efficacement seule qu'à l'état apparié. Dans les situations de stress cellulaire, CHIP apparaît généralement comme un homodimère - une association de deux protéines identiques - et sert principalement à dégrader les protéines mal repliées et défectueuses. CHIP nettoie ainsi la cellule. À cette fin, CHIP collabore avec des protéines auxiliaires pour attacher une chaîne de la petite protéine ubiquitine à des protéines mal repliées. Les protéines défectueuses sont ainsi reconnues et éliminées par la cellule. De plus, CHIP régule également la transduction du signal du récepteur de l'insuline. CHIP lie l'ubiquitine au récepteur pour le dégrader et arrêter l'activation des produits géniques qui prolongent la vie.
Une équipe de recherche basée à Cologne dirigée par le professeur Thorsten Hoppe a maintenant montré dans des expériences avec le nématode Caenorhabditis elegans et des cellules humaines que CHIP peut également se marquer avec de l'ubiquitine, ce qui empêche sa formation de dimères. Le monomère CHIP est plus efficace que le dimère CHIP pour réguler la signalisation de l'insuline. L'étude du cluster d'excellence pour les réponses au stress cellulaire dans les maladies associées au vieillissement (CECAD) de l'Université de Cologne a été publiée dans Molecular Cell sous le titre "A Dimer-Monomer Switch Controls CHIP-Dependent Substrate Ubiquitylation and Processing."
"Le fait que CHIP fonctionne seul ou en paire dépend de l'état de la cellule. En cas de stress, il y a trop de protéines mal repliées ainsi que les protéines auxiliaires qui se lient à CHIP et empêchent l'auto-ubiquitylation, l'auto-marquage avec l'ubiquitine", a déclaré Vishnu Balaji, premier auteur de l'étude.
"Une fois que CHIP a réussi à nettoyer les protéines défectueuses, il peut également marquer les protéines auxiliaires pour la dégradation. Cela permet à CHIP de s'ubiquityler et de fonctionner à nouveau comme un monomère", a-t-il expliqué. Ainsi, pour que le corps fonctionne correctement, il doit y avoir un équilibre entre les états monomères et dimères de CHIP.
"Il est intéressant de noter que l'équilibre monomère-dimère de CHIP semble être perturbé dans les maladies neurodégénératives", a déclaré Thorsten Hoppe. "Dans les ataxies spinocérébelleuses, par exemple, différents sites de CHIP sont mutés, et il fonctionne principalement comme un dimère. Ici, un passage à plus de monomères serait une approche thérapeutique possible."
Dans l'étape suivante, les scientifiques veulent savoir s'il existe d'autres protéines ou récepteurs auxquels le monomère CHIP se lie et régule ainsi leur fonction. Les chercheurs s'intéressent également à savoir dans quels tissus et organes et dans quelles maladies les monomères ou dimères CHIP sont présents en plus grand nombre, afin de pouvoir développer à l'avenir des thérapies plus ciblées. Le lien entre l'agrégation des protéines et le vieillissement