Vue d'artiste d'une unité organisationnelle désassemblée d'ADN, un domaine d'association topologique (TAD). Dans l'analyse des données, ces domaines apparaissent comme des triangles qui peuvent être restructurés dans différents tissus. Crédit :Alessa Ringel/MPIMG
Les couches de contrôle des gènes permettent à l'ADN d'ajouter de manière flexible de nouvelles informations. Les gènes et leurs commutateurs génétiques sont organisés en unités fonctionnelles pour activer ou désactiver les gènes selon les besoins. La perturbation de ces unités peut entraîner des maladies, mais une nouvelle étude montre clairement qu'elles sont plus robustes et flexibles qu'on ne le pensait auparavant. Une équipe internationale de chercheurs a découvert qu'un gène peut encore fonctionner même lorsque de nouveaux segments d'ADN sont insérés dans la même unité organisationnelle génomique.
Deux mètres d'ADN sont insérés dans le minuscule noyau de chaque cellule humaine. Pour fournir à la cellule la bonne information au bon moment, la molécule d'ADN est emballée et regroupée efficacement en unités fonctionnelles. Les gènes se rassemblent généralement avec leurs séquences de contrôle pour construire des espaces de travail physiquement séparés. Mais que se passe-t-il lorsque ces unités sont perturbées au cours de l'évolution ou dans le génome d'un patient ?
"Certains des réarrangements génomiques que nous observons en clinique provoquent des maladies, tandis que d'autres non", explique Stefan Mundlos de la Charité-Universitätsmedizin Berlin et responsable du groupe de recherche Développement et maladie à l'Institut Max Planck de génétique moléculaire (MPIMG). "Nous ne comprenons toujours pas pourquoi c'est le cas."
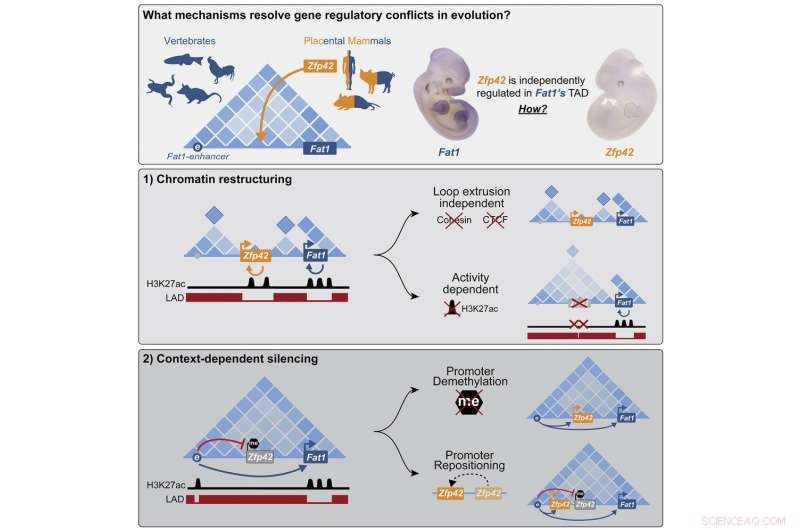
En fait, de nombreuses parties du génome contiennent des conflits de régulation. Une nouvelle étude publiée dans la revue Cell donne les premiers indices sur la façon dont ils sont résolus. L'équipe de chercheurs de Mundlos a étudié un exemple où un nouveau gène a été intégré avec succès dans le génome sans perturber les mécanismes de contrôle préexistants des gènes voisins. L'équipe espérait que cela pourrait également être utilisé pour tirer des conclusions sur des circonstances similaires dans les cellules des patients.
Les chercheurs ont exploré une mutation qui s'est produite chez l'ancêtre de tous les mammifères placentaires, un groupe qui comprend les humains, mais pas les marsupiaux comme l'opossum. La mutation a inséré le nouveau gène Zfp42 directement dans l'espace de travail de l'important gène du développement Fat1, un gène impliqué dans la croissance et la migration des cellules.
"Nous avons constaté que les cellules font face à l'invité indésirable avec deux mécanismes distincts, selon la situation dans laquelle les gènes sont nécessaires", explique Michael Robson, qui a dirigé le projet. "Dans certains tissus, le nouveau gène est mis au silence épigénétiquement et complètement désactivé. Au début du développement de l'embryon, cependant, les deux gènes sont actifs et la cellule reconstruit cette partie du génome en nouvelles unités fonctionnelles qui permettent un contrôle individuel."
Un nouveau venu dans l'atelier
Robson, son doctorat. Alessa Ringel, étudiante, et leurs collègues ont étudié l'espace de travail organisationnel de Fat1. Comme beaucoup d'autres gènes, il est chargé de s'activer à des moments et à des endroits spécifiques par d'autres séquences d'ADN appelées activateurs. Pour permettre aux activateurs et aux gènes de communiquer, l'ADN se plie et se plie ensuite pour les rassembler dans un espace de travail abrité. Ces unités de travail fonctionnelles de l'ADN sont appelées domaines topologiquement associés (TAD).
Chez les poulets ou les opossums, seul le gène Fat1 est situé dans le même TAD que ses activateurs. Lorsque le chercheur a utilisé la technique "Hi-C" pour voir quelles parties de l'ADN se touchent le plus fréquemment, le gène et son activateur se sont comportés comme prévu. Chez ces animaux, l'ADN semblait s'enrouler en une seule boule, permettant aux deux séquences génétiques de s'entremêler, activant ainsi Fat1.
"Mais chez les mammifères placentaires comme les souris ou les humains, c'est un peu plus compliqué", explique Ringel, qui est le premier auteur de la publication. Juste entre le gène Fat1 et son activateur, il y a ce nouveau gène appelé Zfp42. Le même activateur devrait contrôler les deux gènes, mais ce n'est pas le cas. "Les deux gènes semblent très bien s'entendre - ils ont un comportement complètement indépendant, devenant actifs dans différents tissus à différents moments de développement."
Résumé graphique. Crédit :Cellulaire (2022). DOI :10.1016/j.cell.2022.09.006
Soit vous vous endormez, soit vous reconstruisez votre espace de travail
Pour aller au fond de la question de savoir comment les gènes parviennent à s'éviter, les chercheurs ont comparé des cellules de différents tissus de souris :le membre embryonnaire en développement et les cellules souches embryonnaires.
De ces études, les chercheurs ont appris que dans les membres embryonnaires, l'amplificateur contacte effectivement les deux gènes, mais Zfp42 reste inactif. Il s'avère que le nouveau venu est toujours dans le même espace de travail mais dort tranquillement dans un coin. Le gène avait été réduit au silence par la méthylation de l'ADN, une modification chimique qui verrouille les gènes dans un état désactivé. Mais pour endormir le gène Zfp42, il faut qu'il soit exactement au bon endroit. Dès que les chercheurs l'ont expérimentalement coupé-collé juste un peu de chaque côté, il a été activé par l'amplificateur de Fat1.
Les scientifiques ont été surpris de constater que dans les cellules des cellules souches embryonnaires de souris, l'ADN autour des deux gènes est organisé de manière complètement différente. Zfp42 et Fat1 créent désormais leurs propres espaces de travail physiquement séparés avec leurs propres amplificateurs respectifs.
Le TAD original se divise en plus petites gouttes d'ADN pour séparer les deux gènes. Cela ressort non seulement des expériences Hi-C qui ont cartographié les points de contact entre les segments d'ADN, mais aussi des images microscopiques à haute résolution et des modèles informatiques qui ont montré que chaque gène établissait son propre petit espace de travail.
Un système de contrôle génétique robuste et flexible
Ces deux nouveaux mécanismes révèlent comment un seul "espace de travail" d'ADN peut être facilement modifié pour héberger des activités géniques entièrement différentes. "Il est fascinant d'étudier comment différentes couches de contrôle des gènes se complètent", déclare Ringel. "Nous avons été surpris par la flexibilité de nos génomes pour s'adapter et contrôler les gènes dans différentes situations. Par exemple, nos résultats montrent que les TAD peuvent avoir des structures d'ADN dynamiques plutôt que statiques."
Le TAD du gène Fat1 a été maintenu de manière stable pendant des centaines de millions d'années d'évolution des poissons et des grenouilles aux marsupiaux, ajoute le chef de projet Robson. "Les espaces de travail TAD semblent au premier abord fragiles car tant de choses peuvent mal tourner s'ils sont dérangés", dit-il. "Mais les nouveaux gènes doivent aller quelque part et nous montrons comment l'évolution peut modifier efficacement les domaines de régulation pour ajouter en toute sécurité de nouveaux gènes et fonctions."
"Il est intéressant de noter que ce cadre évolutif reflète ce que nous voyons souvent chez les patients présentant des altérations génomiques extrêmes telles que la chromothripsie", déclare Mundlos. "Ces patients peuvent avoir des chromosomes brisés mais ne présenter que des symptômes relativement légers. Cela pourrait s'expliquer par ces mécanismes de régulation supplémentaires qui compensent les effets nocifs en utilisant les outils dont dispose le génome." Explorer les frontières moléculaires de l'ADN