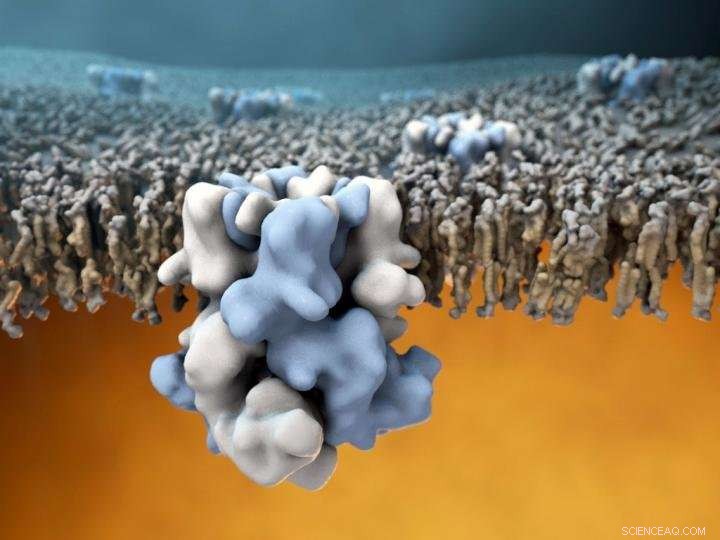
Le canal ionique TRPM8 (bleu et blanc au centre) est intégré dans la membrane externe des cellules, et est capable de détecter les températures froides à l'extérieur (la moitié supérieure de l'image), et communiquer cette information à l'intérieur cellulaire chaud (moitié inférieure de l'image). Crédit :Gabe Lander et Graham Johnson
Une équipe de chercheurs du Scripps Research Institute (TSRI) et de l'Université Duke a effectué la première détermination de la structure atomique du Transient Receptor Potential Melastatine 8 (TRPM8), un capteur moléculaire dans les extrémités nerveuses qui détecte les températures froides ainsi que le menthol et d'autres produits chimiques qui induisent des sensations de froid.
Cette découverte devrait stimuler les efforts en cours des scientifiques pour cibler TRPM8 de manière thérapeutique. Les composés médicamenteux qui interagissent avec le capteur de froid, comme le font déjà les pommades contenant du menthol, peuvent être en mesure de traiter certaines formes de douleur chronique et d'inflammation, migraines et même cancers.
"Connaître la structure atomique de TRPM8 et comment il réagit au froid, le menthol et d'autres stimuli devraient aider à la conception de nouveaux médicaments puissants et sélectifs ciblant ce capteur, " a déclaré le directeur de l'étude Gabriel C. Lander, Doctorat., professeur agrégé à l'IRST, qui a codirigé l'étude avec le Dr Seok-Yong Lee de la Duke University School of Medicine.
La découverte, publié le 7 décembre 2017 dans la revue Science , est aussi une prouesse technique de taille. Depuis que la protéine de détection du froid a été identifiée pour la première fois en 2002, des équipes du monde entier ont essayé mais n'ont pas réussi à déterminer la structure atomique de TRPM8 en utilisant la cristallographie aux rayons X, traditionnellement la méthode incontournable pour résoudre les structures de grandes protéines. L'obtention d'une structure à haute résolution de TRPM8 a posé un défi majeur pour les biologistes structurels en partie à cause de l'instabilité du canal lorsqu'il est isolé de son environnement natif dans la membrane cellulaire. Sans support membranaire, TRPM8 a tendance à perdre son intégrité structurelle, rendant la cible très difficile à étudier. La structure du capteur TRPM8 est également relativement complexe, étant composé de quatre copies identiques de la protéine codée par le gène TRPM8.
Pour ce projet, Lander et co-premier auteur Mengyu Wu, un étudiant diplômé dans son laboratoire, a plutôt opté pour la cryo-microscopie électronique (cryo-EM), une méthode de détermination de la structure de plus en plus privilégiée pour les études structurelles difficiles. Lee et son équipe ont commencé par cribler les protéines TRPM8 de plus d'une douzaine d'espèces animales différentes, y compris les humains, souris, et les oiseaux, pour en trouver un qui était susceptible d'être "le mieux comporté" pour une étude cryo-EM. Ils se sont installés sur la protéine TRPM8 d'un oiseau appelé moucherolle à collier.
"Toutes les preuves indiquent que le moucherolle TRPM8 fonctionne de la même manière que les mammifères TRPM8, nous sommes donc convaincus que notre analyse structurelle se traduira directement par la forme humaine de ce capteur, ", a déclaré Lander.
Les scientifiques ont été confrontés à de nombreux obstacles en raison de l'instabilité inhérente de TRPM8 en dehors de son environnement membranaire natif. "Même dans la journée suivant l'expédition des échantillons de Duke à TSRI, le complexe protéique commencerait à se désagréger, " a déclaré Wu. " Le laboratoire de Lee a stratégiquement ajouté quelques mutations stabilisantes à la protéine afin qu'elle soit moins sujette à la dégradation. " Ying Yin, un étudiant diplômé du laboratoire Lee, est également retourné et méticuleusement tamisé à travers plusieurs conditions de purification pour conférer une stabilité supplémentaire à l'échantillon.
La protéine s'est également comportée différemment de la plupart des échantillons sur lesquels le laboratoire Lander travaille généralement pour la microscopie électronique, et il a fallu plus d'un an aux chercheurs pour identifier les bonnes conditions pour imager cette biomolécule difficile.
"Nous avons dû jeter le livre de règles et repenser l'approche habituelle pour résoudre ce genre de structure, " dit Lander.
Grâce à ces adaptations, les chercheurs ont pu obtenir le premier aperçu structurel de TRPM8 à une résolution globale d'environ 4 Angströms (0,4 milliardième de mètre). Le modèle atomique résultant contenait également quelques surprises. "D'autres groupes ont émis des hypothèses sur la structure de TRPM8 et comment il interagit avec des partenaires de liaison tels que le menthol, mais ce que nous avons découvert, c'est que pratiquement toutes ces suppositions éclairées étaient assez éloignées, " a déclaré Lander. En particulier, la pochette de reliure pour le menthol s'est avérée être dans un endroit inattendu, différent de l'emplacement de liaison du ligand dans d'autres capteurs TRP.
"Une chose que cette structure nous dit, c'est que les capteurs TRP ne fonctionnent pas tous de la même manière, et donc je m'attends à ce que nous découvrions de nombreux nouveaux mécanismes de capteurs à mesure que nous étudions davantage ces structures TRP, ", a déclaré Lander.
TRPM8 intéresse l'industrie pharmaceutique en partie à cause de l'analgésique, effets anti-inflammatoires qu'il peut avoir lorsqu'il est activé. De plus, des variantes de son gène ont été liées à une prédisposition aux migraines, et les scientifiques ont montré que la manipulation de TRPM8 peut provoquer des douleurs de type migraine chez les animaux.
"TRPM8 est également anormalement exprimé dans certaines prostates, cancers du sein et autres, ce qui en fait une cible chimiothérapeutique potentielle, " a déclaré Wu.
Bien que TRPM8 soit surtout connu comme un capteur nerveux périphérique de températures modérément froides (inférieures à environ 25°C) et de molécules à sensation de froid telles que le menthol, on le trouve également dans de nombreux autres tissus normaux, même au plus profond du corps, et ses fonctions dans ces tissus restent largement floues. Une compréhension détaillée de l'interaction structurelle de TRPM8 avec ses partenaires de liaison naturels devrait conduire au développement de meilleures sondes moléculaires qui peuvent aider les scientifiques à révéler ses diverses fonctions.
Les laboratoires Lander et Lee s'efforcent maintenant de mieux comprendre comment TRPM8 interagit avec le menthol et d'autres molécules thérapeutiques partenaires de liaison.