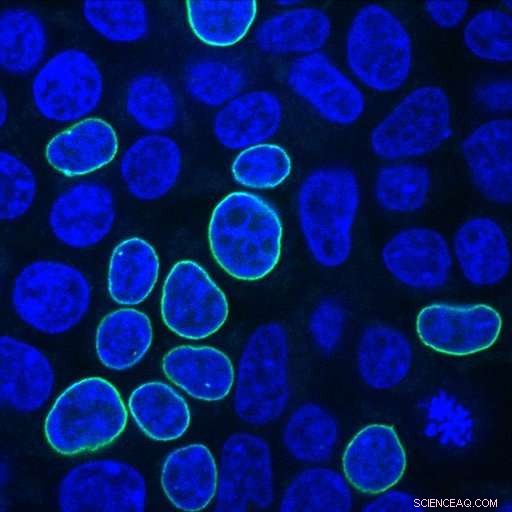
Les cellules rénales embryonnaires humaines brillent en vert après réparation d'une rupture d'ADN induite par CRISPR avec un fragment PCR codant pour une protéine fluorescente et des bras d'homologie avec 33 nucléotides. Crédit :Alexandre Paix
Les scientifiques de Johns Hopkins ont développé une méthode simplifiée et des "règles" d'efficacité associées pour introduire de nouvelles séquences d'ADN dans les cellules après avoir utilisé l'outil de coupe de gènes connu sous le nom de CRISPR. Les scientifiques disent que la méthode, qu'ils ont basé sur des tests avec des embryons de souris et des milliers de cellules humaines, pourrait améliorer la cohérence et l'efficacité de l'édition du génome.
La nouvelle méthode et son développement sont décrits en ligne le 28 novembre dans le Actes de l'Académie nationale des sciences .
"CRISPR est un outil pour aider les scientifiques à modifier le génome, prédire le résultat de certains traits et les étudier, mais l'outil lui-même ne fait que créer des cassures dans le génome. Il ne contrôle pas comment une nouvelle séquence d'ADN est insérée dans le génome, " dit Géraldine Seydoux, Doctorat., le professeur Huntington Sheldon en découverte médicale au département de biologie moléculaire et de génétique et vice-doyen à la recherche fondamentale à la faculté de médecine de l'université Johns Hopkins, et chercheur au Howard Hughes Medical Institute.
« Nous avons entrepris d'étudier comment les cellules réparent les cassures induites par CRISPR dans le but d'utiliser le processus naturel de réparation de l'ADN de la cellule pour introduire de nouvelles séquences dans le génome. Nous avons été surpris de découvrir que les cellules copient facilement des séquences d'ADN étranger pour réparer les cassures d'ADN. , tant que les ADN étrangers sont linéaires, " ajoute Seydoux. " En étudiant comment les fragments d'ADN étrangers sont copiés au cours du processus de réparation, nous avons proposé quelques règles simples pour rendre l'édition du génome aussi efficace que possible, optimiser l'outil, et le faire en toute confiance."
CRISPR, qui représente une courte répétition palindromique groupée régulièrement espacée, a gagné en popularité parmi les scientifiques au cours des cinq dernières années en tant qu'outil pour couper efficacement l'ADN. Il a été adapté pour être utilisé dans les cellules de mammifères à partir d'un processus de défense virale naturel dans les cellules bactériennes qui consiste à créer des coupures mortelles dans l'ADN viral. Essentiellement, l'outil est un ensemble simplifié de « ciseaux » moléculaires.
La croyance dominante, parmi les scientifiques, est que les cellules réparent les cassures de l'ADN en insérant un ensemble aléatoire de nucléotides, les éléments constitutifs chimiques de l'ADN. Cela détruit généralement tout gène situé à l'endroit où l'ADN est rompu.
Il est également bien connu des scientifiques que, parfois, les cellules utilisent une source différente - une séquence d'un autre morceau d'ADN, ou ADN "donneur"—pour sceller la rupture de l'ADN. Cependant, la nouvelle séquence "donneuse" ne peut pas être insérée seule dans un espace vide du génome.
Au lieu, le nouveau donneur d'ADN a besoin d'une sorte de ruban à chaque extrémité pour l'aider à rester dans l'espace créé par la coupe. Les scientifiques appellent cette bande les bras "homologiques" de l'ADN du donneur.
Les bras d'homologie sont constitués de nucléotides qui chevauchent les parties intactes de l'ADN avec un code génétique correspondant. Cela aide l'ADN du donneur à "coller" à l'ADN intact.
Encore, les scientifiques considéraient l'utilisation de l'ADN du donneur comme un moyen inefficace de réparer le génome, en supposant qu'il nécessitait des bras d'homologie longs, en particulier lors de l'insertion d'une longue séquence d'ADN, et ADN simple brin ou circulaire, qui sont difficiles à préparer en grandes tailles.
Au fur et à mesure que les scientifiques ont acquis plus d'expérience avec CRISPR, Seydoux dit, "Des questions se sont posées sur les règles de conception optimales pour l'ADN du donneur et la longueur des bras d'homologie."
Cherchant des réponses à ces questions, les scientifiques de Johns Hopkins ont inséré diverses combinaisons d'ADN de donneur dans des cellules rénales embryonnaires humaines, connus pour leur capacité à bien se développer et pour leur utilisation fréquente dans la recherche contre le cancer. Les scientifiques ont utilisé l'ADN d'un donneur avec un gène qui code pour une protéine fluorescente, qui brille en vert dans la membrane nucléaire de la cellule lorsque l'insertion du gène est réussie.
L'associé de recherche de Johns Hopkins, Alexandre Paix, a découvert que les fragments d'ADN linéaires fonctionnent très bien en tant que donneurs, et sont deux à cinq fois plus efficaces que les ADN circulaires (appelés plasmides) dans les cellules humaines. "L'ADN linéaire est très facile à préparer en laboratoire, par PCR, " dit Paix, se référant aux outils de réaction en chaîne par polymérase, qui sont utilisés pour amplifier l'ADN.
Paix a également testé différentes longueurs de bras d'homologie. Il a découvert que le point idéal pour les bras d'homologie est d'environ 35 nucléotides de long, beaucoup plus court que ce que les scientifiques utilisent habituellement.
Spécifiquement, il a été constaté que les bras d'homologie de 33 à 38 nucléotides de longueur étaient aussi efficaces que ceux de 518 nucléotides, produisant entre 10 et 20 % de modifications réussies dans des conditions optimales. En revanche, lorsque les scientifiques ont testé des bras d'homologie de 15 et 16 nucléotides de long, les taux de réussite d'insertion ont diminué de moitié. Ils ont répété ces résultats à trois endroits différents du génome humain.
Ils ont également constaté que la séquence nouvellement insérée, sans compter les bras d'homologie, peut aller jusqu'à 1, 000 nucléotides de longueur.
L'équipe a obtenu des taux de réussite entre 10 et 50 pour cent avec des inserts allant de 57 à 993 nucléotides de long. Les séquences plus courtes ont été mieux insérées que les plus longues. Par exemple, nouvelles séquences qui étaient 57, 714 et 993 nucléotides de long ont été insérés avec succès 45,4, 23,5 et 17,9 pour cent du temps, respectivement. Au-delà de 1, 000 nucléotides, nouveaux inserts avec 1, 122 et 2, 229 nucléotides ont eu peu de succès, environ 0,5 pour cent du temps. "A cette taille, il devient très difficile d'introduire la quantité d'ADN donneur nécessaire à l'édition. Les cellules ont tendance à "s'étouffer" avec tant d'ADN, " dit Seydoux.
Finalement, l'équipe a également découvert que le taux de réussite de l'édition atteint son maximum lorsque la nouvelle séquence est positionnée à moins de 30 nucléotides du site de coupure CRISPR. "Au-delà de 30 nucléotides, l'insertion n'est pas réalisable, " dit Seydoux.
"Ces paramètres devraient s'adapter à la plupart des gènes que les scientifiques cherchent à modifier. En fait, la plupart des expériences impliquent l'édition de seulement deux à trois nucléotides à proximité du site de coupure CRISPR, " ajoute Seydoux.
L'équipe de recherche a également testé si la même approche pouvait fonctionner sur des embryons de souris. En utilisant un fragment PCR avec des bras d'homologie de 36 nucléotides, l'équipe a réussi à insérer une séquence de 739 nucléotides codant pour une protéine fluorescente dans 27 des 87 (31 %) embryons de souris.
L'équipe de recherche de Seydoux utilise déjà les règles de réparation pour étudier l'ADN chez Caenorhabditis elegans, une espèce de ver, et les chercheurs étudient si les règles de réparation s'appliquent à d'autres types de cellules humaines.
Avant que les directives ne soient largement adoptées, Seydoux dit qu'ils devraient être testés dans davantage de types de cellules humaines et d'autres organismes.