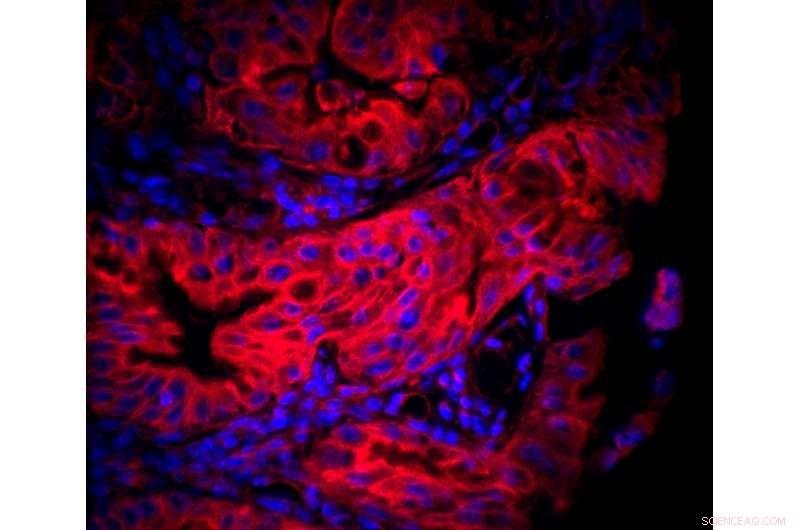
Tissu gastrique infecté par H. pylori . Les noyaux sont en bleu (Hoechst) et les mitochondries en rouge (étiquetage Mitotracker). Crédit :Laurent Chatre - CNRS/Institut Pasteur
Des scientifiques de l'Institut Pasteur et du CNRS ont récemment identifié de nouvelles stratégies utilisées par la bactérie Helicobacter pylori pour infecter les cellules. En ciblant spécifiquement les mitochondries, ces bactéries, en dépit d'être extracellulaire, peut optimiser l'infection chez l'hôte. Ces découvertes ouvrent la voie à de nouvelles stratégies pour lutter contre l'infection à H. pylori, qui est associé à la plupart des cas de cancer gastrique et à plusieurs autres troubles gastriques. Les résultats ont été publiés le 21 novembre dans la revue Rapports scientifiques .
Helicobacter pylori est un agent pathogène bactérien qui colonise l'estomac d'environ la moitié de la population mondiale. L'infection par H. pylori est acquise dans l'enfance et dure des décennies. H. pylori est le principal facteur de risque de cancer gastrique et est lié à plus de 80 pour cent des cas. Cancer de l'estomac, la troisième cause la plus fréquente de décès liés au cancer, a souvent un mauvais pronostic car il a tendance à être diagnostiqué à un stade avancé. Il est responsable d'environ 800, 000 décès chaque année dans le monde.
H. pylori possède plusieurs facteurs de virulence qui interagissent avec des cibles spécifiques dans la cellule et affectent directement la gravité de la maladie gastrique. La vacuolisation de la cytotoxine A (VacA) était auparavant le seul facteur principal de H. pylori connu pour agir sur les mitochondries, provoquant un dysfonctionnement des membranes cellulaires et des organites, aboutissant finalement à la mort cellulaire.
Des scientifiques de l'Institut Pasteur et du CNRS ont découvert que H. pylori utilise au moins deux stratégies supplémentaires pour cibler les mitochondries. Ces stratégies ne conduisent pas à la mort cellulaire, mais maintenir un environnement propice à la prolifération bactérienne.
Leurs résultats montrent que H. pylori affecte à la fois les systèmes de transport mitochondrial (utilisés pour transférer des protéines dans les mitochondries) et la machinerie de réplication et de maintenance du génome mitochondrial. Les scientifiques ont également découvert que, contrairement à ce que l'on croyait auparavant, VacA n'est pas le seul composant de H. pylori capable d'affecter les mitochondries. Cela suggère que la bactérie peut produire d'autres facteurs interagissant avec les mitochondries qui n'ont pas encore été identifiés.
La co-auteure Miria Ricchetti de l'Institut Pasteur déclare :« Les dommages aux mitochondries causés par la bactérie H. pylori sont temporaires et disparaissent une fois l'infection éliminée. Malgré des niveaux de stress remarquablement élevés, mitochondries, comme des cellules, peut rester fonctionnel et résister à l'infection plus longtemps qu'on ne le pensait auparavant. Il est important pour nous de garder cela à l'esprit lorsque nous cherchons des stratégies pour inhiber le potentiel pathogène de la bactérie."
Co-auteur Eliette Touati de l'Institut Pasteur, dit, « Nous avons observé dans un modèle murin que ce type de dommages est associé à une aggravation des lésions gastriques. Les dommages peuvent donc affecter la chronicité et la gravité de l'infection par H. pylori. Comprendre ces nouvelles interactions entre l'agent pathogène et les cellules hôtes (via les mitochondries ) est vitale pour le développement de stratégies efficaces pour lutter contre l'infection à H. pylori. L'objectif est de réduire la persistance de la bactérie dans l'estomac et de lutter contre les affections associées, surtout le cancer."