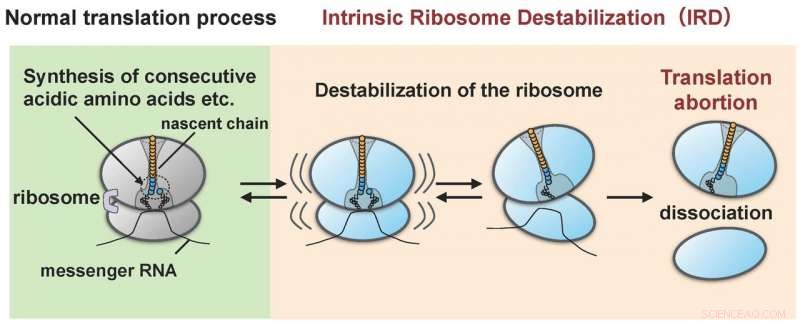
Le ribosome est déstabilisé par la protéine (chaîne naissante) qu'il a lui-même synthétisée (IRD) et se sépare en grandes et petites sous-unités. Par conséquent, la synthèse des protéines se termine à mi-cycle sans atteindre le point final. Crédit :Hidekii Taguchi
Un groupe de recherche conjoint de l'Institut de technologie de Tokyo (Tokyo Tech) et de l'Université Sangyo de Kyoto a découvert qu'une protéine, lors de sa synthèse, peut déstabiliser la structure du ribosome et mettre fin prématurément à sa propre synthèse, et a constaté que ce phénomène est utilisé pour adapter la cellule à son environnement.
Fond
Les protéines sont des molécules fonctionnelles, qui supportent la vie et sont des structures tridimensionnelles de chaînes polypeptidiques, chaînes d'acides aminés liés. La configuration des acides aminés sur cette chaîne (la séquence) est écrite dans la séquence d'ADN. Des chaînes polypeptidiques se forment là où le ribosome, la machinerie de synthèse des protéines, réside sur une copie de la séquence d'ADN (ARN messager). Il commence à polymériser les acides aminés un par un en sélectionnant parmi 20 types d'acides aminés à ajouter au lien selon le code génétique. Il est complété au point d'extrémité où la chaîne se détache du ribosome.
Le processus de synthèse d'une protéine au niveau d'un ribosome est appelé « traduction, " et toutes les protéines de tous les organismes vivants, y compris les humains, sont produits par la traduction. On avait pensé que, dans le processus de liaison des acides aminés au ribosome, la chaîne polypeptidique nouvellement formée (chaîne naissante) a été synthétisée en continu.
Dans des études récentes de ce groupe de recherche et d'autres, il est devenu évident que la fluctuation de la vitesse se produit de manière significative dans la traduction - que certaines chaînes naissantes, selon la séquence d'acides aminés, agir sur le ribosome qui le forme pour ralentir le pas de traduction.
Aperçu des réalisations de la recherche
Le groupe de recherche dirigé par Hideki Taguchi à Tokyo Tech et Koreaki Ito à l'Université Sangyo de Kyoto a découvert que, lorsqu'un système de traduction acellulaire reconstitué d'E. coli a été réalisé pour traduire des protéines ayant des séquences d'une dizaine d'acides aminés acides (acides aspartique et glutamique) ou des séquences dans lesquelles soit un acide aminé acide et un acide aminé appelé proline sont liés alternativement, la traduction s'arrête à mi-chemin lorsqu'une telle séquence a été traduite. Cet événement avorté survient lorsque les ribosomes synthétisant la séquence d'acides aminés se déstabilisent sous l'action de la chaîne naissante (les chercheurs désignent cet « IRD » :« déstabilisation intrinsèque du ribosome »). Il en résulte que le ribosome se divise en sous-unités grande et petite (Figure 1). Le ribosome, avec son rôle de synthèse de plusieurs milliers ou dizaines de milliers de types de protéines au sein de la cellule, avait été pensé pour être aux commandes dans la liaison de toutes les combinaisons de séquences d'acides aminés. Cependant, la découverte de l'IRD, dans lequel le ribosome est déstabilisé lors de la traduction par des chaînes naissantes qu'il synthétise lui-même, indique que la traduction est quelque chose qui progresse avec le risque potentiel d'être avorté. Les protéines qui incluent des séquences d'acides aminés qui déclenchent l'IRD ne sont pas en mesure de terminer leur synthèse.
A première vue, ce phénomène d'IRD peut apparaître comme un défaut du ribosome, mais qu'indique-t-il pour les organismes vivants ?
Les chercheurs ont découvert que les organismes vivants possèdent également un mécanisme pour contrer l'IRD. Cette découverte les a amenés à utiliser un mutant d'E. coli manquant de ce mécanisme, avec des ribosomes donc légèrement déstabilisés et sujets à l'IRD, et analyser toutes les protéines à l'intérieur d'une cellule (le protéome). Par conséquent, l'équipe a constaté que, chez le mutant, les quantités cellulaires d'un certain nombre de protéines variaient par rapport à la souche sauvage. En particulier, MgtA, une protéine membranaire qui transporte l'ion magnésium dans les cellules, s'est avéré être exprimé plus de dix fois plus. De façon intéressante, le gène appelé mgtL et régulant l'expression de MgtA possédait une séquence IRD. Le résultat de l'analyse a montré qu'E. coli régule l'expression de MgtA, utilisant un mécanisme spécial mettant en vedette le phénomène IRD dû à la séquence de mgtL, en réponse aux changements dans les concentrations de magnésium dans la cellule.
Les ions magnésium sont nécessaires à de nombreux processus vitaux à l'intérieur de la cellule, et est requis pour la traduction, en particulier, pour stabiliser le ribosome. Ainsi, les résultats de cette recherche suggèrent qu'E. coli a acquis un mécanisme pour maintenir la concentration en ions magnésium cellulaire en utilisant la capacité IRD de mgtL à exprimer une abondance de MgtA lorsque son environnement de croissance devient pauvre en magnésium. En d'autres termes, un organisme vivant dispose d'un mécanisme de suivi des modifications de l'environnement intracellulaire en tirant parti du phénomène d'IRD (Figure 2).
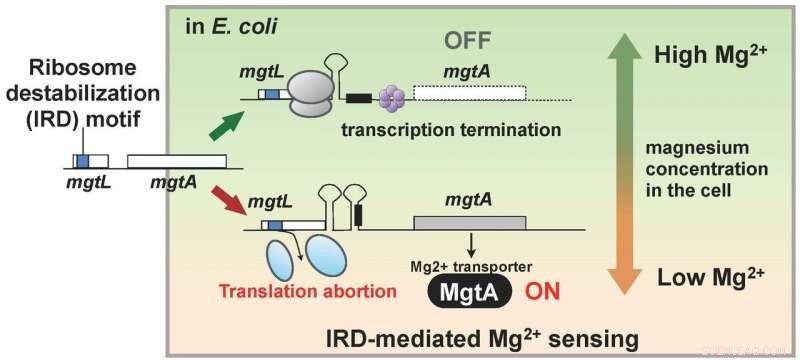
Le gène, mgtL, le contrôle de l'expression de la protéine membranaire MgtA qui transporte le magnésium dans les cellules a une séquence déstabilisante des ribosomes, et la traduction est interrompue lorsque la concentration en magnésium à l'intérieur de la cellule est faible. Il existe un mécanisme qui active la synthèse de MgtA lorsque la traduction de mgtL est interrompue, et on pense que l'expression abondante résultante de MgtA augmente la concentration en ions magnésium à l'intérieur de la cellule. Crédit :Hideki Taguchi
Développements futurs
Cette étude a révélé que, en plus de contenir des informations qui déterminent les structures tridimensionnelles des protéines, les séquences d'acides aminés ont même la capacité d'influencer la stabilité de la machinerie qui la synthétise et d'interrompre la traduction à mi-cycle, finalement. Cela améliore notre compréhension du fondement des processus vitaux, qui sont soutenus par l'expression régulée de l'information génétique. De bonne heure, l'arrêt prématuré de la traduction n'avait pas été considéré à ce jour comme un processus vital dans les sciences de la vie. Taguchi et les membres de l'équipe croient que leur accomplissement peut être étendu, en lien avec la prospérité actuelle des sciences de la vie, à diverses applications telles que la production de nouvelles protéines utiles ou le développement de produits biopharmaceutiques.