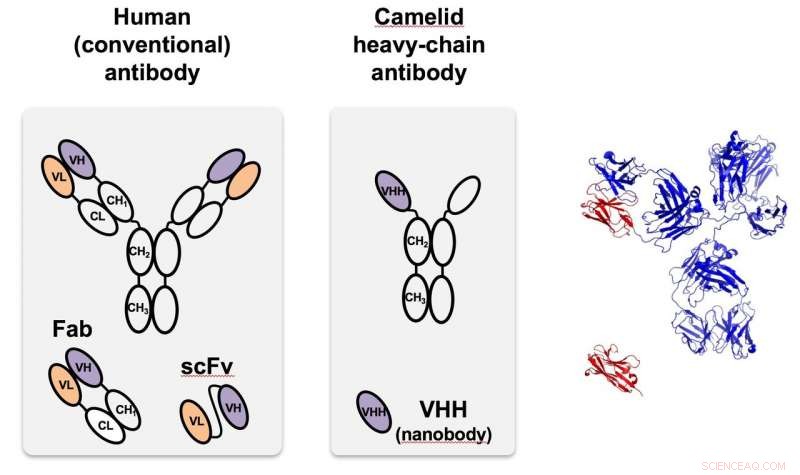
Le nanocorps camélidé (au centre), identifié pour la première fois chez les chameaux, est un anticorps à chaîne lourde qui est beaucoup plus petit et plus facile à programmer que les anticorps trouvés dans la plupart des organismes, y compris les humains, comme ça à gauche. A droite, le camélidé monomère (rouge) est comparé à la structure de l'anticorps humain de taille normale. VHH est un nanocorps conçu pour cibler les protéines fluorescentes vertes utilisées dans les tests de preuve de principe chez Rice. Crédit :Segatori Research Group/Rice University
Un anticorps à l'échelle nanométrique trouvé pour la première fois chez des chameaux combiné à une molécule dégradant les protéines est une nouvelle plate-forme efficace pour contrôler les niveaux de protéines dans les cellules, selon les scientifiques de l'Université Rice. La technique pourrait aider la recherche fondamentale sur la dynamique cellulaire ainsi que la conception de circuits de gènes synthétiques.
Ingénieur chimiste et biomoléculaire du riz Laura Segatori, L'ancien étudiant diplômé Wenting Zhao et l'ancienne étudiante de premier cycle Lara Pferdehirt ont inventé un système de reconnaissance bifonctionnel qu'ils appellent NanoDeg. Il leur permet de cibler des protéines spécifiques dans une cellule et de réguler strictement leur dégradation.
Le système plug-and-play permettra aux biologistes de synthèse d'étudier la fonction d'une protéine spécifique dans l'environnement cellulaire en évaluant comment le niveau d'expression de la protéine affecte la vie d'une cellule, dit Segatori.
La recherche apparaît dans la revue American Chemical Society ACS Biologie Synthétique .
NanoDeg accélère la protéolyse - la dégradation enzymatique des protéines - pour contrôler les niveaux de protéines ciblées après la traduction.
Une fonction provient de l'anticorps monocaténaire des camélidés, qui peut être personnalisé pour cibler des protéines spécifiques. Lorsque les anticorps ont été découverts chez les chameaux (et plus tard les requins), les chercheurs ont rapidement reconnu leurs propriétés uniques, y compris leur petite taille, haute solubilité et capacité à reconnaître même les cibles cachées ou dans des états intermédiaires. Ils sont beaucoup plus petits que les anticorps trouvés naturellement chez les humains et la plupart des autres organismes, mais peuvent être facilement fabriqués et modifiés dans les bactéries et autres cellules.
L'autre fonction repose sur degrons, courtes séquences de protéines qui sont responsables de la régulation du taux de dégradation d'une protéine. Ceux-ci peuvent également être personnalisés pour régler l'épuisement d'une protéine cible aux niveaux souhaités.
Lorsqu'ils sont combinés en tant que NanoDegs, ils deviennent puissants, plateforme universelle de modulation des taux de protéines cellulaires, dit Segatori.
"Essentiellement, il nous permet de contrôler la quantité spécifique de protéines dans les cellules, " dit-elle. " Nous pouvons l'adapter pour cibler n'importe quelle protéine dans une cellule, et une fois que le nanocorps étiqueté degron se lie à ce partenaire, l'ensemble du complexe est dégradé.
« L'avantage de ce système est qu'il cible l'expression au niveau des protéines, " a déclaré Segatori. " Typiquement, quand les gens veulent moduler la quantité de protéines dans les cellules, ils agissent au niveau de l'ADN ou de l'ARN – le niveau génétique. Mais en agissant au niveau des protéines, nous pouvons cibler différentes modifications post-régulation, et bien plus important, nous avons beaucoup plus de contrôle sur le taux et l'étendue de l'épuisement de la protéine."
Comme preuve de principe, les chercheurs ont conçu un circuit génétique synthétique qui exprime à la fois la protéine fluorescente verte (GFP), que les chercheurs utilisent pour rendre compte des processus cellulaires, et un NanoDeg qui le cible. "Nous avons utilisé la GFP car c'est un rapporteur couramment utilisé et la fluorescence est facile à mesurer, " a déclaré Segatori. "Lorsque le nanocorps reconnaît GFP, l'ensemble du complexe est pris pour dégradation."
Il sera également utile à ceux qui veulent des informations plus claires sur les activités des protéines dans les cellules.
"Dites que vous concevez un circuit génétique dans lequel l'expression de la GFP est activée lorsque la cellule est soumise à un stress, comme le manque de nutriments ou la chaleur, par exemple, " a déclaré Segatori. "Lorsque la cellule est exposée au stimulus, La GFP est exprimée et vous pouvez détecter une augmentation de la fluorescence cellulaire.
"Mais quand vous enlevez le stimulus, la décroissance du signal ne reflète pas nécessairement la décroissance du stimulus; il reflète la stabilité du rapporteur GFP, " dit-elle. " Ce que nous avons fait, c'est créer un circuit génétique dans lequel l'expression de la GFP est activée sous stimulus, mais lorsque le stimulus est désactivé, le NanoDeg dégrade la GFP très rapidement. Cela augmente la sensibilité et la résolution dynamique d'un circuit génétique synthétique."