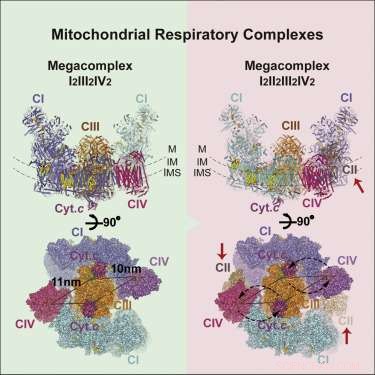
Structure du mégacomplexe respiratoire. Crédit: Cellule (2017). DOI :10.1016/j.cell.2017.07.050
(Phys.org)—Pièce par pièce, le schéma de circuit pour le transport des électrons dans les mitochondries est presque terminé. Chaque nouvelle structure obtenue pour l'un des cinq complexes respiratoires restreint davantage le puzzle assemblé. Finalement, de gros blocs sont disposés dans leurs emplacements définitifs. La composition exacte du plus gros bloc, le soi-disant mégacomplexe, a longtemps échappé aux chercheurs. Maintenant, après imagerie de 140 sous-unités individuelles jusqu'à une résolution de 3,9 ans, le Full Monty a été mis à nu. Les chercheurs décrivent dans Cellule exactement comment le mégacomplexe respiratoire humain est constitué et semble fonctionner.
Fini les jours simples. Fini les schémas grossiers avec des complexes alignés dans la membrane dans une rangée de un à cinq avec des électrons et leurs porteurs mobiles se déplaçant séquentiellement de gauche à droite. Apportez la stoechiométrie, et apportez le 2-D. La stoechiométrie signifie qu'en réalité, chaque complexe est en fait représenté dans le mégacomplexe à un numéro de copie spécifique. Ces copies supplémentaires doivent aller quelque part dans toute représentation précise. Non seulement que, mais les plus petits porteurs d'électrons ont besoin d'un espace pour traîner. Ils doivent également être présents dans des canaux qui restent locaux au mégacomplexe ou qui se diffusent éventuellement vers d'autres. La géométrie finale dictera où les chemins d'électrons séparés fusionnent ou bifurquent, et où ils sont le plus susceptibles de fonctionner en sens inverse.
L'image du mégacomplexe (MC) qui a émergé a la stoechiométrie suivante :MCI2II2III2IV2. Cela signifie que les complexes I, II, III, &IV sont chacun présents en double tandis que le complexe V est absent. Il est configuré à l'intérieur de la membrane en une structure circulaire avec le dimère CIII situé au centre et alimenté par les complexes périphériques CI et CIV. Les complexes CII ne sont apparemment pas des exigences essentielles à la structure centrale, mais sont plutôt théorisés pour être coincés dans des lacunes selon les besoins. Les auteurs ont également trouvé des preuves d'une interprétation légère du mégacomplexe qui peut parfois être assemblée avec un seul complexe CI.
Le positionnement central du dimère CIV suggère une certaine logique. CIV, ou la cytochrome oxydase, est la terre de repos terminale pour les électrons entrant dans la chaîne. Ceux qui sont arrivés jusque-là ont été abaissés aussi loin que possible dans la hiérarchie des potentiels de réduction. Ici, ils sont plongés dans des molécules d'oxygène en attente, qui s'épuisent ensuite sous forme de molécules d'eau. Les électrons à haut potentiel conditionnés sous forme de NADH pénètrent dans le complexe à son périmètre et sont canalisés vers le centre. L'absence de complexes C5 n'est peut-être pas si inhabituelle, considérant qu'ils se trouvent généralement sous forme de rangées de dimères en forme de "V" qui déforment la membrane en des régions de forte courbure au niveau des coudes de la crête.
Avec la structure de base en main, les chercheurs ont pu suggérer quelques principes de fonctionnement de base. Leur inclusion et leur placement de CII expliquent efficacement le transport inverse des électrons du succinate au NADH. La géométrie proposée crée également un Q-pool scellé (un transporteur d'électrons liposoluble) qui est accessible à la fois à CI et à CII. Les auteurs ont également pu identifier l'identité et les emplacements de plusieurs molécules lipidiques qui sécurisent le complexe au sein de la membrane, Plus précisément, plusieurs molécules pivots de phosphatidyléthanolamine, phosphatidylcholine, et cardiolipine. Ils ont également pu identifier les voies de transfert d'électrons préférées ou les plus efficaces, qui à leur tour limitent le nombre d'électrons pouvant être transférés simultanément entre les porteurs actifs.
L'un des avantages immédiats de ce nouveau travail est que bon nombre des mutations pathogènes précédemment incomplètement comprises dans les protéines respiratoires ont désormais un sens. Avant d'avoir une structure mégacomplexe, les chercheurs n'avaient d'autre choix que de se concentrer sur la façon dont les mutations affectent la structure ou la fonction des complexes individuels. Comme il s'avère, la plupart des mutations enregistrées dans les sous-unités centrales Ci et CIII cible se trouvent dans les résidus impliqués dans les sites d'interaction protéine-protéine entre les complexes. (Par exemple, mutations associées à la maladie dans les sous-unités NDUFV1, NDUFS1, ND1, ND5, et ND6 en CI et sous-unité MT-CYB en CIII). Cela montre la futilité d'essayer de ne regarder que des protéines et des sous-unités uniques en l'absence d'une vue d'ensemble.
Il convient de mentionner que les efforts antérieurs pour définir la stoechiométrie des complexes respiratoires ont obtenu des résultats légèrement différents selon les organes et les espèces étudiés. Pomme de terre, vache, mouton, et levure, qui n'ont même pas toujours un complexe CI à proprement parler, ont tous été étudiés. Il n'est pas surprenant que des circonstances différentes puissent exiger une stoechiométrie et une forme différentes. Différentes structures mégacomplexes entraîneraient différents avantages pour la canalisation du substrat, amélioration catalytique, séquestration des intermédiaires réactifs, ou la stabilisation structurelle. Une étude portant spécifiquement sur les mitochondries cardiaques a défini le rapport pour les complexes de phosphorylation oxydative I:II:III:IV:V à 1:1,5:3:6:3. Dans ce cas, les auteurs ont appelé leur complexe le « respirosome ».
Avec le mégacomplexe respiratoire maintenant vraisemblablement fissuré, le prochain grand pas en avant consiste à intégrer certaines des autres superstructures du système mitochondrial à double membrane dans des modèles pour prédire pourquoi les cristea ont l'apparence qu'elles ont. Les complexes d'import massifs TIM-TOM couvrent les deux membranes et sont intimement associés aux mitoribosomes qui traduisent les protéines mitochondriales. Les mitoribosomes, à son tour, sont localisés dans les nucléoïdes sous-jacents associés à la membrane qui abritent des copies de l'ADNmt. Par analogie avec le nucléole du noyau, cette structure composite nucléoïde-ribosome a été appelée « mitochondriole ». par exemple, est la navette la plus importante dans le cerveau et équilibre les principaux métabolites entre les mitochondries et le cytosol. La navette citrate-pyruvate pour la synthèse des acides gras et la navette glycérol phosphate (au moins pour la graisse brune et le muscle du vol des insectes) doivent aussi trouver des foyers où ils peuvent bien s'entendre avec les voisins immédiats.
L'organisation endémique des protéines dans ces mégastructures suggère que les mitochondries pourraient ressembler davantage à un cristal dur qu'à un protoplasme fluide. Pourtant, d'une manière ou d'une autre, ils apparaissent d'une souplesse remarquable lorsqu'il s'agit de fusion et de fission. Qu'arrive-t-il à leur structure membranaire sous ce genre de changements ? Les complexes sont-ils temporairement désassemblés et solubilisés comme le cil primaire et le centriole des cellules régulières pendant la mitose ? Un nouvel indice fascinant émerge du travail montrant que les mitochondries se connectent les unes aux autres à travers des « nanotunnels » de leur propre construction. Ces nanotunnels sont complètement différents (pour autant que nous le sachions) de la marque de « nanotubes tunnels » infusés dans le cytosquelette que les cellules elles-mêmes utilisent pour transférer des mitochondries entières les unes aux autres.
Une revue récente de Martin Picard et de ses collègues de Tendances en biologie cellulaire suggère une façon dont ces nanotunnels pourraient se former lorsque les mitochondries sont fixées au cytosquelette. Si des protéines motrices comme la kinésine s'emparent d'un patch d'une mitochondrie fixe, il pourrait extraire un fin nanotunnel alors que les moteurs de la kinésine contre un autre microtubule. Le corps rigide des mitochondries et sa structure membranaire resteraient vraisemblablement intacts. Cette projection pourrait alors rencontrer une autre mitochondrie à laquelle elle se rattache.
Picard a précédemment montré qu'environ la moitié des mitochondries dans le muscle cardiaque ont des jonctions intermitochondriales (IMJ) et des crêtes qui s'alignent en motifs réguliers qui s'étendent à travers les réseaux mitochondriaux. Il est peu probable que cet alignement de réseau étrange résulte d'événements de fission récents, car les mitochondries cardiaques sont fixées en place et présentent une dynamique de fission/fusion minimale. Il a récemment été démontré que les IMJ contrôlent la contractilité en découplant rapidement les mitochondries liées lorsque leurs propres membranes sont dépolarisées. Une chose qui serait d'un intérêt immédiat, ici, est de réexaminer la stoechiométrie des sous-unités respiratoires dans les mitochondries cardiaques humaines pour compléter les résultats rapportés ici pour les cellules rénales embryonnaires humaines.
© 2017 Phys.org