Vous pouvez rechercher une image d'un atome sur Internet et vous en trouverez une, même si personne n'a vu d'atome auparavant. Mais nous avons une estimation de ce à quoi ressemble un seul atome grâce au travail d'un groupe de scientifiques différents comme le physicien danois Niels Bohr.
Les atomes sont les éléments constitutifs de la matière - un seul atome de tout élément individuel est l'entité la plus fondamentale de la nature qui respecte toujours les règles de la physique que nous pouvons observer dans la vie quotidienne (les particules subatomiques qui composent les atomes ont leurs propres règles spéciales) . Les scientifiques soupçonnaient que les atomes existaient depuis longtemps avant de pouvoir conceptualiser leur structure - même les anciens Grecs pensaient que la matière de l'univers était composée de composants si petits qu'ils ne pouvaient pas être décomposés en quelque chose de plus petit, et ils appelèrent ces unités fondamentales atomes , ce qui signifie "indivisé". A la fin du 19e siècle, il était entendu que les substances chimiques pouvaient être décomposées en atomes, qui étaient très petits et les atomes de différents éléments avaient un poids prévisible.
Mais alors, en 1897, Le physicien britannique J.J. Thomson a découvert que les électrons – des particules chargées négativement à l'intérieur des atomes que tout le monde avait cru pendant près d'un siècle comme étant entièrement indivisibles – étaient les plus petites choses qui existaient. Thomson a juste émis l'hypothèse que les électrons existaient, mais il n'a pas pu déterminer exactement comment les électrons s'intègrent dans un atome. Sa meilleure hypothèse était le "modèle de pudding aux prunes, " qui dépeint l'atome comme une tarte chargée positivement parsemée de zones chargées négativement éparpillées comme des fruits dans un dessert à l'ancienne.
"Les électrons se sont avérés être électriques négatifs, et tous de même masse et très petits par rapport aux atomes, " dit Dudley Herschbach, un chimiste de Harvard qui a partagé le prix Nobel de chimie en 1986 pour ses "contributions concernant la dynamique des processus chimiques élémentaires, " dans un e-mail. " Ernest Rutherford a découvert le noyau en 1911. Les noyaux étaient électriques positifs, avec des masses diverses mais beaucoup plus grandes que les électrons, mais de très petite taille."
Niels Bohr était l'élève de Rutherford qui a courageusement repris le projet de son mentor de déchiffrer la structure de l'atome en 1912. Il ne lui a fallu qu'un an pour proposer un modèle fonctionnel d'un atome d'hydrogène.
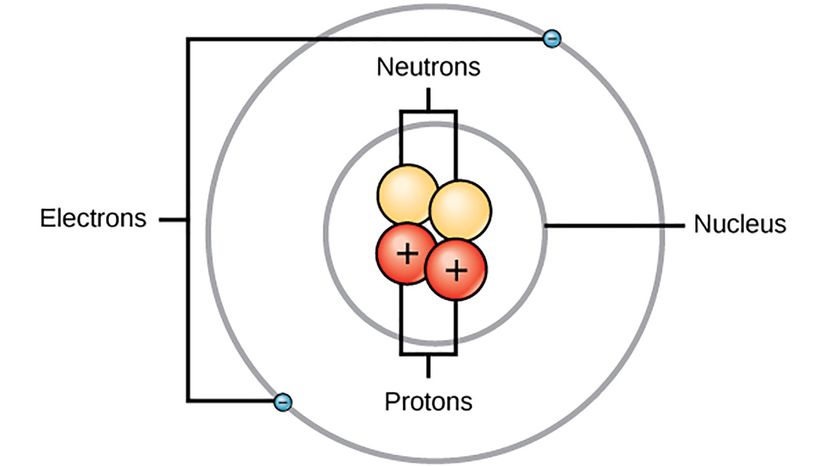
"Le modèle de Bohr de 1913 pour l'atome d'hydrogène avait des orbites d'électrons circulaires autour du proton - comme les orbites de la Terre autour du soleil, " dit Herschbach. " Bohr avait utilisé un modèle simple et régulier pour le spectre de l'atome d'hydrogène, qui avait été trouvé par Johann Balmer en 1885. Il a également utilisé l'idée de l'idée quantique, trouvé par Max Planck en 1900."
En 1913, le modèle de Bohr était un pas de géant car il incorporait des caractéristiques de la mécanique quantique naissante dans la description des atomes et des molécules. Cette année, il a publié trois articles sur la constitution des atomes et des molécules :le premier et le plus célèbre était consacré à l'atome d'hydrogène et les deux autres décrivaient certains éléments avec plus d'électrons, en utilisant son modèle comme cadre. Le modèle qu'il a proposé pour l'atome d'hydrogène avait des électrons se déplaçant autour du noyau, mais uniquement sur des pistes spéciales avec différents niveaux d'énergie. Bohr a émis l'hypothèse que la lumière a été émise lorsqu'un électron a sauté d'une piste d'énergie plus élevée à une piste d'énergie inférieure - c'est ce qui a fait briller l'hydrogène dans un tube de verre. Il a bien compris l'hydrogène, mais son modèle était un peu glitch.
"Le modèle n'a pas réussi à prédire la bonne valeur des énergies de l'état fondamental des atomes à plusieurs électrons et des énergies de liaison des molécules - même pour les systèmes à 2 électrons les plus simples, comme l'atome d'hélium ou une molécule d'hydrogène, " dit Anatoly Svidzinsky, professeur à l'Institute for Quantum Science and Engineering de Texas A&M, dans un entretien par e-mail. "Donc, déjà en 1913, il était clair que le modèle de Bohr n'est pas tout à fait correct. Même pour l'atome d'hydrogène, le modèle de Bohr prédit à tort que l'état fondamental de l'atome possède un moment angulaire orbital non nul."
Lequel, bien sûr, pourrait ne pas avoir beaucoup de sens pour vous si vous n'êtes pas un physicien quantique. Cependant, Le modèle de Bohr a été accéléré pour recevoir un prix Nobel de physique en 1922. Mais alors même que Bohr cimentait sa réputation dans le monde de la physique, les scientifiques amélioraient son modèle :
"Le modèle de Bohr pour l'atome d'hydrogène a été amélioré par Arnold Sommerfeld en 1916, " dit Herschbach. " Il a trouvé des orbites elliptiques qui représentaient des raies spectrales proches de celles qui provenaient d'orbites circulaires. Le modèle de Bohr-Sommerfeld pour l'atome d'hydrogène est basique, mais le quantum et la relativité sont devenus des aspects majeurs."
Entre 1925 et 1928, Werner Heisenberg, Max Born, Wolfgang Pauli, Erwin Schrödinger et Paul Dirac ont développé ces aspects bien au-delà du modèle atomique de Bohr, mais le sien est de loin le modèle d'atome le plus reconnu. Les modèles atomiques que la physique quantique nous a donnés ressemblent moins à un soleil entouré de planètes électroniques qu'à de l'art moderne. Il est probable que nous utilisions encore le modèle de Bohr car c'est une bonne introduction au concept d'atome.
« En 1913, Le modèle de Bohr a démontré que la quantification est une bonne voie à suivre dans la description du micro-monde, " dit Svidzinsky. " Ainsi, Le modèle de Bohr a montré aux scientifiques une direction à rechercher et a stimulé le développement ultérieur de la mécanique quantique. Si vous connaissez le chemin, alors tôt ou tard, vous trouverez la bonne solution au problème. On peut considérer le modèle de Bohr comme l'un des panneaux de direction le long d'un sentier de randonnée dans le monde quantique."
Maintenant c'est intéressantle père de Niels Bohr, Christian Bohr, a été nominé pour trois prix Nobel différents de physiologie de la médecine, bien qu'il n'ait jamais gagné.