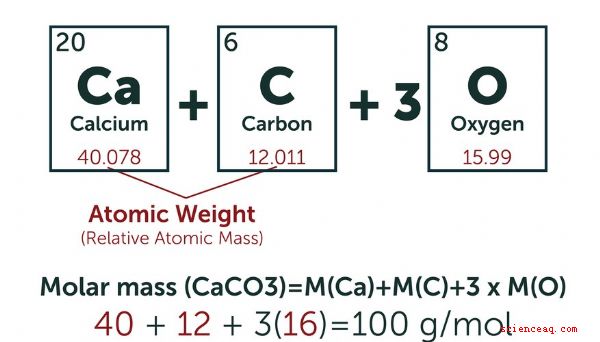
Pour simplifier leurs calculs, les chimistes ont créé une unité standard pour le nombre d'atomes d'un composé particulier impliqué dans une réaction ou un autre processus chimique. Ils définissent une mole (mol) comme la quantité de toute substance qui a le même nombre d'unités fondamentales que 12 grammes de carbone-12, qui est le nombre d'Avogadro (6.022 × 10 23). Le système de mesure SI (métrique) définit une millimole (Mmol) comme un millième de mole. Vous calculez généralement le nombre de moles d'une substance en pesant la quantité que vous avez sous la main. Si vous voulez convertir en Mmol, multipliez par 10 3 (1,000). TL; DR (Trop long; Pas lu) Un mole est égal au nombre d'Avogadro de particules d'un composé particulier. Une millimole (Mmol) est un millième de mole. Comment calculer les moles Les masses atomiques sont mesurées en unités de masse atomique (UMA). Une UMA est exactement 1/12 de la masse du noyau d'un atome de carbone-12 dans son état fondamental. Une mole d'une substance est définie comme étant égale au nombre de particules d'Avogadro de cette substance. Selon cette définition, le poids d'une mole d'une substance en grammes est le même que le poids d'une particule individuelle de cette substance dans l'UMA. Par exemple, le poids atomique du carbone-12 est de 12 AMU, donc une mole de carbone-12 pèse 12 grammes. Considérons un récipient rempli d'hydrogène gazeux (H 2). Chaque particule dans le récipient est une molécule composée de deux atomes d'hydrogène, de sorte que vous devez seulement connaître la masse atomique de l'hydrogène pour calculer le poids moléculaire. La plupart des versions du tableau périodique répertorient la masse atomique de chaque élément sous son symbole. Pour l'hydrogène, qui a un seul proton dans son noyau, c'est 1,008 AMU, qui est une moyenne de tous les isotopes naturels de l'hydrogène. En conséquence, la masse atomique de l'hydrogène gazeux est de 2,016 UM et une mole d'hydrogène gazeux pèse 2,016 grammes. Pour trouver le nombre de moles dans votre échantillon, vous devez peser l'échantillon en grammes et diviser ce poids par le poids moléculaire de l'hydrogène gazeux en grammes. Par exemple, un échantillon pesant 15 grammes de gaz hydrogène pur contient 7,44 moles. Convertir en Mmol Parfois, les quantités étudiées sont si petites que leur expression en moles est lourde. Entrez la millimole. En multipliant le nombre de moles par un millier, vous pouvez convertir un très petit nombre en un plus gérable. Ceci est particulièrement pratique lorsque l'on traite des unités de volume de l'ordre du millilitre. 1 mol = 1,000 Mmol Solution Concentration Les chimistes utilisent la molarité comme mesure de la concentration d'un composé particulier en solution. Ils définissent la molarité comme le nombre de moles par litre. Vous convertissez la molarité en millimolarité en multipliant par 1000. Par exemple, une solution à 1 mol (molaire, également écrite en M) a une concentration de 1 mole par litre. Cela équivaut à une solution à 1 000 Mmol (millimolaire, parfois aussi écrite en mM), qui contient 1 000 Mmol par litre. Exemple Une solution contient 0,15 gramme de carbonate de calcium. Combien de millimoles est-ce? La formule chimique du carbonate de calcium est CaCO 3. Le poids atomique du carbone (C) est d'environ 12 AMU, celui de l'oxygène (O) d'environ 16 AMU et celui du calcium (Ca) d'environ 40 AMU. Chaque molécule de carbonate de calcium pèse ainsi 100 UMA, ce qui signifie qu'une mole pèse environ 100 grammes. Un poids de 0,15 gramme représente 0,15 g ≤ 100 g /mol = 0,0015 mole. Cela équivaut à 1,5 Mmol. Quelle est la molarité et la millimolarité de cette quantité de carbonate de calcium dans 2,5 litres de solution? La molarité est définie comme le nombre de moles par litre, donc diviser le nombre de moles par 2.5 pour obtenir la molarité: 0.0015 ÷ 2.5 = 0.0006 M Multiplier par 1.000 pour obtenir la millimolarité = 0.6 mM Notez que vous obtenez le même résultat pour la millimolarité si vous divisez le nombre de millimoles par le volume de solution.