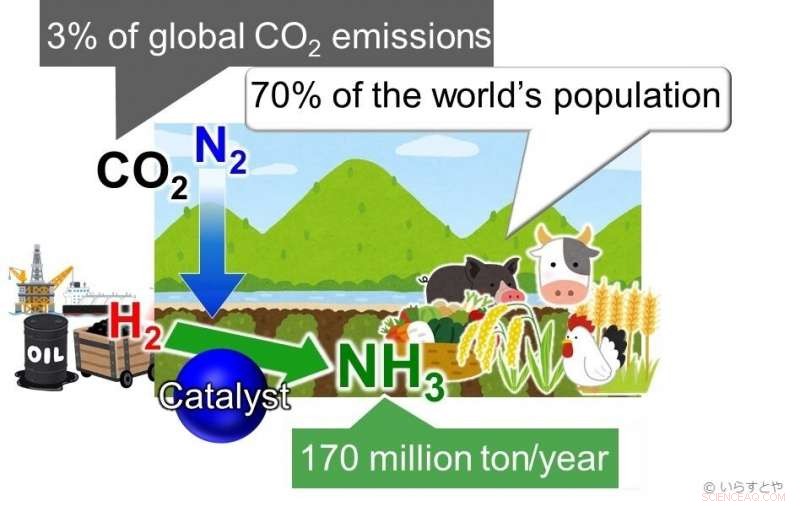
L'ammoniac (NH3) est l'un des produits chimiques industriels les plus importants aujourd'hui, synthétisé à l'échelle mondiale pour être utilisé dans les engrais qui permettent ensuite la production alimentaire pour environ 70 % de la population mondiale. L'ammoniac est actuellement obtenu en faisant réagir l'azote (N2) de l'air avec l'hydrogène (H2). Cette réaction nécessite une énergie élevée et est, donc, alimenté par des combustibles fossiles, contribuant à plus de 3 % des émissions mondiales de CO2. Crédits :Irasutoya, Michikazu Hara
Des scientifiques de l'Institut de technologie de Tokyo (Tokyo Tech) ont développé un catalyseur amélioré en prenant l'hydrure de calcium comme agent déshydratant commun et en y ajoutant du fluorure. Le catalyseur facilite la synthèse de l'ammoniac à seulement 50 °C, en utilisant seulement la moitié de l'énergie que nécessitent les techniques existantes. Cela ouvre les portes à la production d'ammoniac avec une faible consommation d'énergie et une réduction des émissions de gaz à effet de serre.
L'ammoniac est essentiel pour la fabrication d'engrais pour les plantes, qui à son tour nourrit environ 70 % de la population mondiale. Dans l'industrie, l'ammoniac est produit via le procédé Haber-Bosch, où le méthane est d'abord mis à réagir avec de la vapeur pour produire de l'hydrogène, et l'hydrogène est ensuite mis à réagir avec de l'azote pour donner de l'ammoniac. Le problème avec ce processus est que lorsque la température augmente, le rendement diminue. Pour continuer à obtenir un bon rendement, la pression appliquée dans la chambre de réaction doit être augmentée. Cela demande beaucoup d'énergie. Plus loin, les catalyseurs à base de fer utilisés pour la réaction ne sont efficaces qu'au-dessus de 350 °C. Le maintien de températures aussi élevées nécessite également une quantité importante d'énergie. Pour couronner le tout, le rendement n'est que de 30 à 40 %.
Les combustibles fossiles sont actuellement utilisés pour alimenter le processus, apportant de grandes quantités de dioxyde de carbone dans l'atmosphère. Alternatives aux ressources renouvelables, comme l'énergie éolienne, ont été appliqués, mais ceux-ci ne se sont pas avérés durables. Pour augmenter le rendement tout en réduisant les dommages à l'environnement, donc, la réaction doit avoir lieu à basse température. Pour que cela se produise, des catalyseurs permettant la réaction à basse température sont nécessaires.
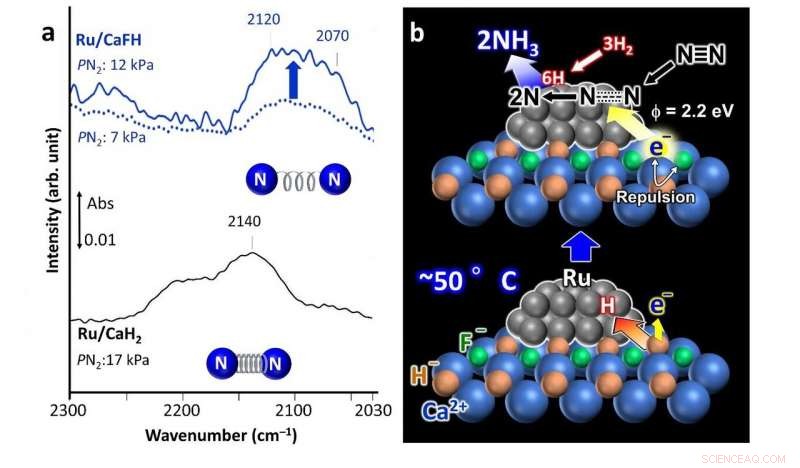
a) Spectres infrarouges de la forme Trans de Fourier (FT-IR) pour l'adsorption d'azote sur le catalyseur Ru/CaFH contenant du fluorure développé (en haut) montrant une liaison affaiblie entre les atomes d'azote par rapport à un catalyseur Ru/CaH2 non modifié (spectre inférieur). b) Mécanisme de réaction proposé utilisant le catalyseur Ru/CaFH. Crédit: Communication Nature
Jusque là, ces catalyseurs ont été insaisissables aux scientifiques. "Les catalyseurs conventionnels perdent l'activité catalytique pour la formation d'ammoniac à partir de N
Leur catalyseur comprend une solution solide de CaFH, avec des nanoparticules de ruthénium (Ru) déposées à sa surface. L'ajout de fluorure (F
-
) en hydrure de calcium (CaH
La liaison calcium-fluorure (Ca-F) est plus forte que la liaison calcium-hydrogène (Ca-H). Donc, la présence de la liaison Ca-F affaiblit la liaison Ca-H et le Ru est capable d'extraire des atomes H du cristal de catalyseur, laissant les électrons à leur place. Les atomes de H se désorbent ensuite des nanoparticules de Ru sous forme de H
Ce nouveau mode de production d'ammoniac permet de réduire les besoins énergétiques, réduisant ainsi les émissions de dioxyde de carbone résultant de l'utilisation de grandes quantités de combustibles fossiles. Les résultats de cette étude mettent en lumière la possibilité d'un procédé Haber-Bosch durable sur le plan environnemental, ouvrant la porte à la prochaine révolution de la production agro-alimentaire.