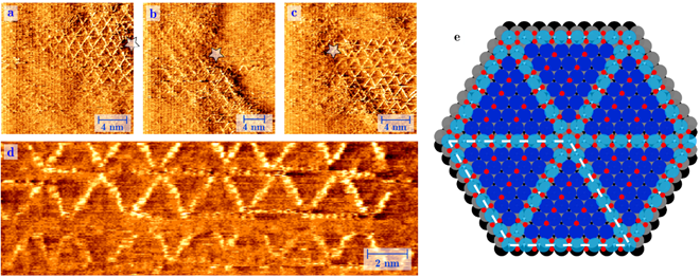
À gauche :Image réalisée avec un microscope à effet tunnel (STM). Image d'une surface de platine sous une pression de 1 atmosphère d'oxygène à 256 °C. Dans ces circonstances, nous voyons la croissance spontanée d'une structure de roue à rayons de rangées de PtO2 intégrées avec de nombreuses erreurs structurelles. A droite :les atomes de platine oxydés en bleu clair, les atomes d'oxygène en rouge et les atomes de platine réguliers en surface en bleu foncé (couche 1), gris (couche 2) et noir (couche 3). Crédit :Université de Leyde
Les voitures sont équipées de catalyseurs pour désamorcer les gaz d'échappement toxiques. Le platine y joue un rôle important. Les physiciens et chimistes de Leyde ont maintenant pour la première fois vu le mécanisme derrière un catalyseur au platine. Avec une compréhension fondamentale du processus, les scientifiques peuvent utiliser ce matériau rare plus efficacement. Parution dans Communication Nature .
Les gaz d'échappement de plus d'un milliard de voitures dans le monde contribuent de manière significative au réchauffement climatique. Mais sans catalyseurs, les voitures seraient encore plus polluantes. Après que les gaz d'échappement toxiques quittent le moteur, les catalyseurs les transforment en substances moins nocives. Le platine joue ici un rôle important, en éliminant le monoxyde de carbone toxique. Ce métal noble est très rare et les scientifiques cherchent donc à l'utiliser le plus efficacement possible.
Platine
Le platine fonctionne comme un catalyseur en collectant des atomes d'oxygène (O), et en les laissant se lier au monoxyde de carbone toxique (CO), pour créer le dioxyde de carbone (CO2) moins nocif. Le physicien Joost Frenken et les chimistes Irene Groot et Matthijs van Spronsen de l'Université de Leiden ont maintenant pour la première fois imaginé comment ce processus fonctionne au niveau atomique. Avec un microscope spécial construit à la maison, ils ont vu une couche d'oxygène ultra-mince se développer sur une surface de platine. Cela s'est produit dans des circonstances réalistes, c'est-à-dire à la même pression et température élevées qu'à l'intérieur d'un moteur, ce qui a rendu l'expérience encore plus difficile. Les chercheurs ont découvert que les atomes d'oxygène sont quelque peu « lâches, " afin qu'ils puissent facilement réagir avec d'autres substances. Ceci fournit pour la première fois une bonne explication de la forte activité catalytique du platine dans les réactions d'oxydation.
Efficacité
En démêlant le mécanisme derrière le catalyseur au platine, les scientifiques de Leiden contribuent à une meilleure compréhension fondamentale de la catalyse. À long terme, les scientifiques pourraient exploiter ces connaissances pour utiliser plus efficacement des matériaux rares comme le platine. Groot : « Alors soit nous avons besoin de moins de platine pour obtenir le même résultat, ou nous comprenons si bien le mécanisme de catalyse derrière le platine que nous pouvons créer un matériau de substitution."