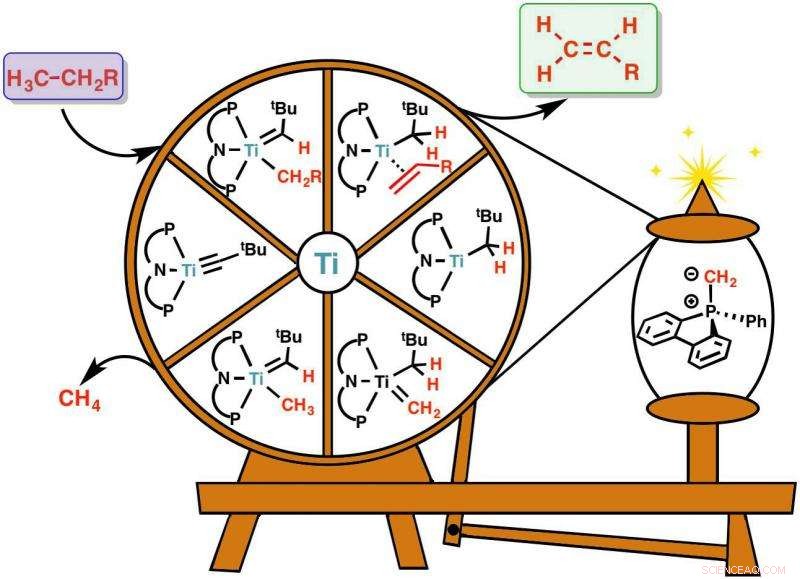
Représentation de la réaction de rupture carbone-hydrogène avec un fuseau. Oléfines, c'est-à-dire des molécules avec une double liaison entre les carbones (C=C, boîte verte) sont générés à partir de molécules non réactives de gaz naturel (boîte violette). La réaction comprend un catalyseur à base de titane (Ti) soigneusement choisi, représenté par la roue et une molécule additive, illustré sur la bobine. L'additif aide la roue à tourner, recycler le catalyseur à sa forme d'origine, il peut donc être réutilisé pour faciliter une autre réaction. Les oléfines sont la matière première chimique pour une variété d'autres produits chimiques, comme les plastiques, polymères conducteurs, médicaments, etc. Cette réaction peut être réalisée à basse température et c'est la première fois qu'elle peut être réalisée à moindre coût. Crédit : Institut des sciences fondamentales
Ils sont tout autour de vous ! La plupart des plastiques, polymères conducteurs, et même les médicaments dérivent de molécules avec une double liaison entre deux atomes de carbone, C=C. Ces molécules sont appelées oléfines et sont principalement produites à partir de combustibles fossiles grâce à un procédé énergivore et polluant appelé vapocraquage. Il nécessite des températures de 800°C et produit le gaz à effet de serre du dioxyde de carbone. Inutile aujourd'hui, Les alternatives à ce procédé qui pourraient apporter des avantages environnementaux et économiques sont très recherchées.
Une équipe de chercheurs du Centre de Fonctionnalisations Catalytiques des Hydrocarbures, au sein de l'Institut des sciences fondamentales (IBS), en collaboration avec le Prof. Daniel J. Mindiola de l'Université de Pennsylvanie, accompli une réaction qui n'était pas possible auparavant; ils produisaient des oléfines avec des ingrédients bon marché facilement disponibles et à basse température (75 °C). Ce résultat de recherche, Publié dans Chimie de la nature , ouvre la voie à une utilisation efficace des gaz naturels pour synthétiser des produits chimiques importants.
Gaz naturels, comme le méthane et l'éthane, ont de fortes liaisons carbone-hydrogène (C-H) difficiles à rompre. L'équipe de recherche a réussi à transformer ces molécules non réactives en oléfines, la matière première chimique d'une myriade de produits que nous utilisons dans notre vie quotidienne.
Ce type de procédé de production d'oléfines est basé sur la déshydrogénation, c'est l'élimination des hydrogènes qui conduit à la création de la liaison C=C, la marque des oléfines. Étant donné que l'énergie nécessaire pour rompre les liaisons C-H fortes est trop élevée, la réaction ne peut être accomplie qu'à l'aide d'autres molécules, appelés catalyseurs. Précédemment, la déshydrogénation n'était possible qu'avec des catalyseurs à base de métaux coûteux, comme l'iridium.
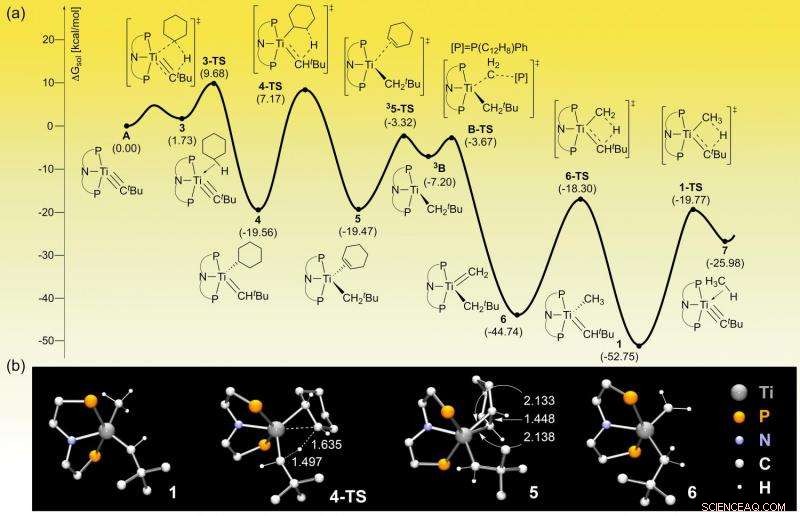
Profil énergétique généré par ordinateur de la réaction. Les simulations informatiques peuvent prédire les composants intermédiaires de la réaction chimique et la quantité d'énergie nécessaire pour les obtenir. Crédit : Institut des sciences fondamentales
L'étude a permis de produire des oléfines à bas prix grâce à un travail d'équipe synergique entre des informaticiens et des chimistes expérimentaux. En simulant l'ensemble du processus chimique, Les informaticiens d'IBS ont conseillé à leurs collègues de l'Université de Pennsylvanie des tests de catalyseurs à base de titane bon marché.
"Nous sommes passés de l'iridium, qui est si rare et cher qu'il est étiqueté "l'élément des dieux", à un métal absolument bon marché, titane; un élément que nous connaissons tous car il est largement utilisé comme pigment blanc pour la céramique, papier, et blanchisseur de dents, " explique BAIK Mu-Hyun, l'auteur principal d'IBS. "La simulation informatique prédit le mouvement de chaque électron et comment les molécules vont interagir, cela nous a donc permis de raccourcir le temps de développement."
Résumer, l'étude a montré que la fabrication d'oléfines à un prix bon marché, manière économe en énergie est possible. La réaction peut être effectuée à basse température et le catalyseur au titane peut être partiellement recyclé, il peut donc être réutilisé pour déshydrogéner davantage de gaz naturel. Le prochain défi de l'équipe de recherche est de rendre le catalyseur à base de titane plus efficace.