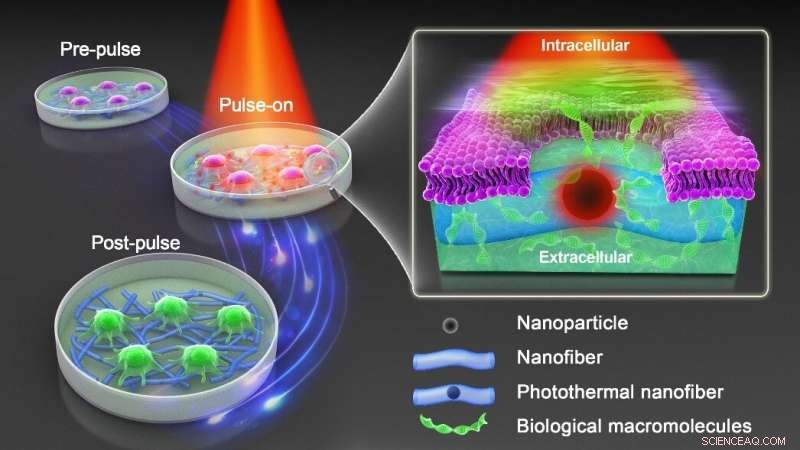
Résumé graphique. Crédit :DOI :10.1038/s41565-021-00976-3
Le professeur Kevin Braeckmans de l'Université de Gand s'est concentré ces 10 dernières années sur une méthode d'ingénierie sûre de cellules thérapeutiques avec des nanofibres photothermiques. Aujourd'hui, Nanotechnologie de la Nature donne un aperçu de la façon dont ces nanofibres photothermiques biocompatibles ont été développées et comment, lors de l'irradiation laser, les cellules qui entrent en contact avec ces nanofibres deviennent perméabilisées et peuvent être transfectées avec une variété de molécules effectrices, y compris les complexes ribonucléoprotéiques CRISPR/Cas9 et les ARNsi. Le professeur Braeckmans et son équipe ont démontré que les cellules, telles que les cellules souches embryonnaires et les lymphocytes T humains, transfectées avec de telles nanofibres sont en excellente santé et conservent leur fonctionnalité thérapeutique.
Nouvelle base pour les thérapies cellulaires
Les thérapies cellulaires constituent une nouvelle forme de traitement dans laquelle des cellules génétiquement modifiées sont injectées au patient afin de prévenir ou de traiter des maladies. Un exemple bien connu est l'utilisation des propres cellules immunitaires d'un patient cancéreux qui peuvent être isolées, génétiquement modifiées et développées dans un environnement de laboratoire, et réinjectées dans le patient pour attaquer les cellules tumorales. La modification génétique des cellules dépend des technologies de délivrance intracellulaire qui ont souvent du mal à obtenir une efficacité suffisante tout en ayant un impact minimal sur la santé et le fonctionnement de la cellule.
La photoporation sensibilisée aux nanoparticules est particulièrement prometteuse à cet égard car elle offre généralement une efficacité élevée, un débit élevé et une faible toxicité. Il est basé sur l'utilisation de nanoparticules sensibles à la lumière, telles que les nanoparticules d'or (NP), qui peuvent former des nanobulles explosives lors d'une irradiation laser pulsée. Ces minuscules explosions peuvent induire de petits pores dans les membranes cellulaires, permettant aux molécules effectrices externes complétées dans le milieu cellulaire de pénétrer dans les cellules. Cependant, la traduction de la photoporation sensibilisée aux nanoparticules en applications cliniques est entravée par le fait que les cellules ont été en contact avec des nanoparticules (non dégradables), ce qui pose des problèmes toxicologiques et réglementaires.
Par conséquent, une nouvelle approche est nécessaire qui conserve l'avantage de la photoporation sensibilisée aux nanoparticules tout en évitant le contact direct des nanoparticules et des cellules. Comme le montre la figure ci-dessus, le professeur Braeckmans et son équipe ont intégré des nanoparticules photothermiques d'oxyde de fer (IONP) dans des nanofibres polymères biocompatibles produites par électrofilage. Le polycaprolacton (PCL) est un polymère biocompatible largement utilisé dans les applications biomédicales, tandis que les IONP sont rentables et ont un large spectre d'absorption de la lumière.
Ils montrent que les cellules adhérentes et en suspension peuvent être transfectées en toute sécurité et efficacement avec une gamme de macromolécules lors d'une irradiation avec des impulsions laser nanosecondes. En effectuant une analyse élémentaire par spectrométrie de masse plasma-tandem à couplage inductif (ICP-MS/MS), ils confirment que les IONP restent intégrés en toute sécurité dans les nanofibres après irradiation laser, de sorte que les cellules traitées sont effectivement exemptes d'exposition directe aux nanoparticules. Des simulations numériques sur le transfert de chaleur des IONP intégrés à la fibre vers les cellules voisines ont été réalisées pour mieux comprendre comment la fluence des impulsions laser, la distribution des IONP et l'état d'agrégation influencent la perméabilité de la membrane cellulaire.
Expérimentalement, l'équipe a montré que la photoporation avec des nanofibres photothermiques pouvait fournir avec succès des molécules biologiques fonctionnelles, y compris des siRNA ou des ribonucléoprotéines CRISP-Cas9 (RNP), aux cellules adhérentes et en suspension, y compris les cellules souches embryonnaires humaines (hESC) et les cellules T humaines primaires. À titre de référence, une comparaison a été effectuée avec l'électroporation de pointe. Alors que les cellules électroporées souffraient de modifications de leur phénotype et de leur fonctionnalité, ce n'était pas le cas des cellules photoporées qui conservaient leur capacité à proliférer et, dans le cas des cellules CAR-T, à tuer les cellules tumorales. Enfin, la photoporation PEN a été utilisée pour transfecter des cellules CAR-T avec des siARN ciblant le récepteur PD1, un inhibiteur de point de contrôle immunitaire bien connu. Il a été confirmé que les cellules traitées avec siPD1 avaient une capacité de destruction des tumeurs améliorée in vivo.
Ensemble, il montre que la photoporation avec des nanofibres photothermiques permet une livraison intracellulaire efficace et sûre d'une large gamme de molécules effectrices dans une variété de types de cellules sans contact avec des nanoparticules photothermiques potentiellement toxiques. "Nous pensons qu'il s'agit d'une étape importante vers l'utilisation de la photoporation pour une production sûre et efficace de thérapies cellulaires génétiquement modifiées", déclare le professeur Braeckmans. Les nanotubes d'oxyde de titane facilitent la photoporation assistée par laser à faible coût