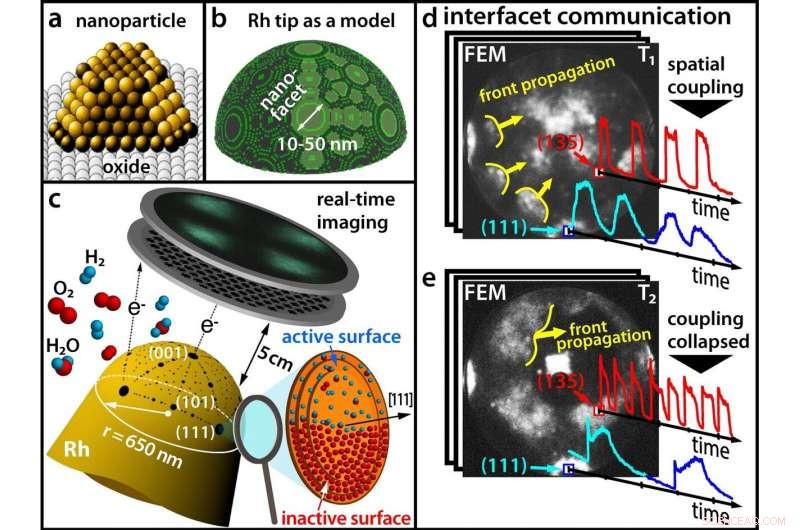
(a) Les catalyseurs modernes sont constitués de nanoparticules ; (b) Une pointe en Rhodium comme modèle pour une nanoparticule ; (c) Tracer une réaction chimique en temps réel avec un microscope à émission de champ (d) A basse température, différentes facettes oscillent en synchronisation (e) À des températures plus élevées, la synchronicité est rompue. Crédit :Université de technologie de Vienne
La plupart des produits chimiques commerciaux sont fabriqués à l'aide de catalyseurs. D'habitude, ces catalyseurs sont constitués de minuscules nanoparticules métalliques qui sont placées sur un support oxyde. Semblable à un diamant taillé, dont la surface est constituée de facettes orientées dans des directions différentes, une nanoparticule catalytique possède également des facettes cristallographiquement différentes, et ces facettes peuvent avoir des propriétés chimiques différentes.
Jusqu'à maintenant, ces différences sont souvent restées inconsidérées dans la recherche en catalyse car il est très difficile d'obtenir simultanément des informations sur la réaction chimique elle-même et sur la structure de surface du catalyseur. A la TU Wien (Vienne), ceci a maintenant été réalisé en combinant différentes méthodes microscopiques :à l'aide de la microscopie électronique de champ et de la microscopie ionique de champ, il est devenu possible de visualiser l'oxydation de l'hydrogène sur une seule nanoparticule de rhodium en temps réel à une résolution nanométrique. Cela a révélé des effets surprenants qui devront être pris en compte dans la recherche de meilleurs catalyseurs à l'avenir. Les résultats sont maintenant présentés dans la revue scientifique Science .
Le rythme des réactions chimiques
« Dans certaines réactions chimiques, un catalyseur peut basculer périodiquement entre un état actif et un état inactif, ", explique le professeur Günther Rupprechter de l'Institut de chimie des matériaux de la TU Wien. "Des oscillations chimiques auto-entretenues peuvent se produire entre les deux états - le chimiste Gerhard Ertl a reçu le prix Nobel de chimie pour cette découverte en 2007."
C'est également le cas des nanoparticules de rhodium, qui sont utilisés comme catalyseur pour l'oxydation de l'hydrogène, la base de chaque pile à combustible. Sous certaines conditions, les nanoparticules peuvent osciller entre un état dans lequel les molécules d'oxygène se dissocient à la surface de la particule et un état dans lequel l'hydrogène est lié.
L'oxygène incorporé modifie le comportement de la surface
"Quand une particule de rhodium est exposée à une atmosphère d'oxygène et d'hydrogène, les molécules d'oxygène sont divisées en atomes individuels à la surface du rhodium. Ces atomes d'oxygène peuvent ensuite migrer sous la couche de rhodium la plus élevée et s'y accumuler sous forme d'oxygène souterrain, " explique le Pr Yuri Suchorski, le premier auteur de l'étude.
Par interaction avec l'hydrogène, ces atomes d'oxygène stockés peuvent alors être à nouveau sortis et réagir avec des atomes d'hydrogène. Puis, il y a à nouveau de la place pour plus d'atomes d'oxygène à l'intérieur de la particule de rhodium et le cycle recommence. "Ce mécanisme de rétroaction contrôle la fréquence des oscillations, " dit Youri Suchorski.
Jusqu'à maintenant, on pensait que ces oscillations chimiques se déroulaient toujours de manière synchrone au même rythme sur l'ensemble de la nanoparticule. Après tout, les processus chimiques sur les différentes facettes de la surface des nanoparticules sont spatialement couplés, car les atomes d'hydrogène peuvent facilement migrer d'une facette vers les facettes adjacentes.
Cependant, les résultats du groupe de recherche du professeur Günther Rupprechter et du professeur Yuri Suchorski montrent que les choses sont en réalité beaucoup plus complexes :dans certaines conditions, le couplage spatial est levé et les facettes adjacentes oscillent soudainement avec des fréquences significativement différentes - et dans certaines régions de la nanoparticule, ces "ondes chimiques" oscillantes ne se propagent pas du tout.
"Cela peut s'expliquer à l'échelle atomique, " dit Youri Suchorski. " Sous l'influence de l'oxygène, des rangées saillantes d'atomes de rhodium peuvent émerger d'une surface lisse.
Si c'est le cas, les facettes individuelles peuvent former des oscillations de différentes fréquences. "Sur différentes facettes, les atomes de rhodium sont disposés différemment sur la surface, " explique Günther Rupprechter. " C'est pourquoi l'incorporation d'oxygène sous les différentes facettes de la particule de rhodium se déroule également à des vitesses différentes, et ainsi des oscillations avec des fréquences différentes résultent sur des facettes cristallographiquement différentes. »
Une pointe d'hémisphère comme modèle de nanoparticules
The key to unraveling this complex chemical behavior lays in using a fine rhodium tip as a model for a catalytic nanoparticle. An electric field is applied, and due to the quantum mechanical tunneling effect, electrons can leave the tip. These electrons are accelerated in the electric field and hit a screen, where a projection image of the tip is then created with a resolution of around 2 nanometers.
In contrast to scanning microscopies, where the surface sites are scanned one after the other, such parallel imaging visualizes all surface atoms simultaneously—otherwise it would not be possible to monitor the synchronization and desynchronization of the oscillations.
The new insights into the interaction of individual facets of a nanoparticle can now lead to more effective catalysts and provide deep atomic insights into mechanisms of non-linear reaction kinetics, pattern formation and spatial coupling.