Schéma de nanotournesols or-ADN auto-assemblés pour une absorption cellulaire améliorée, efficacité de silençage génique accordable, et un effet d'inhibition tumorale contrôlé par irradiation NIR. (A) (a) Assemblage et démontage de la nanostructure de grande taille (nanostournesols en or-ADN 200 nm) de/vers des nanoparticules ultrapetites (NPs Au-POY2T 2 nm). (b) Image TEM représentative des nanotournesols. (c) Chef-d'œuvre :Tournesols (Vincent van Gogh, 1889). (B) Gauche :Rétention tumorale in vivo et pénétration de nanotournesols transformables. À droite :absorption cellulaire améliorée et processus de silençage oncogène contrôlé des nanotournesols in vitro. ① Des nanotournesols de grande taille ont été captés par une cellule MCF-7. Les nanotournesols veillent dans le cytoplasme cellulaire. Lors d'une irradiation NIR, des nanostructures d'or-ADN de grande taille se dissocient et libèrent de petites unités (NPs Au-POY2T 2 nm) pour attaquer le noyau cellulaire. ④ La séquence de silençage POY2T se liera au promoteur P2 de l'oncogène c-myc et régulera à la baisse l'expression c-myc des cellules MCF-7, qui peut être contrôlé (ON/OFF) et régulé (Low/Medium/High) par l'irradiation NIR. Crédit: Avancées scientifiques , doi:10.1126/sciadv.aaw6264
Le développement d'un système d'administration efficace pour des thérapies améliorées et contrôlées basées sur l'interférence génique est un défi existant en biologie moléculaire. Les avancées dans le domaine de la nanotechnologie peuvent fournir un moyen efficace, stratégie interdisciplinaire pour faciliter la livraison d'acide nucléique. Dans un nouveau rapport, Shuaidong Huo et ses collègues des départements interdisciplinaires de nanosciences, Matériaux interactifs, Chimie et recherche sur les polymères en Chine, L'Allemagne et les États-Unis ont utilisé des séquences d'oligonucléotides formant un triplex couplées à son brin complémentaire pour faciliter l'auto-assemblage de nanoparticules d'or ultra-petites.
Les nanostructures de type tournesol résultantes ont montré une forte absorption dans le proche infrarouge (NIR) et une capacité de conversion photothermique. Lorsque les scientifiques ont irradié les structures avec du NIR, les plus grandes nanostructures se sont désassemblées pour générer des nanoparticules ultra-petites modifiées avec la séquence oncogène c-Myc pour cibler directement le noyau des cellules cancéreuses. Huo et al. contrôle du silençage génique en contrôlant de manière synergique le temps de pré-incubation des cellules avec des nanoparticules parallèlement à l'auto-assemblage de la nanostructure (in vitro et in vivo) et le délai d'irradiation NIR. L'étude a fourni un nouveau paradigme pour construire des nanosupports efficaces et adaptés pour des applications d'interférence génique et de délivrance thérapeutique de gènes.
La thérapie génique a un grand potentiel pour traiter une variété de maladies et de complications, y compris l'infertilité, VIH et cancer. Une thérapie génique réussie pour soulager les symptômes de la maladie dépend d'un véhicule ou d'un vecteur de délivrance de gènes efficace. Pendant le processus, le porteur du gène doit traverser de nombreuses barrières biologiques et membranes cellulaires tout en échappant au piégeage endosomal et à la dégradation basée sur les nucléases. Par rapport aux stratégies de diffusion basées sur les virus, les approches de délivrance de gènes non viraux sont confrontées à de nombreux défis au cours du processus de chargement et de libération de l'ADN/ARN, livraison ciblée et absorption intracellulaire, y compris l'incompatibilité par rapport aux réponses immunitaires in vivo.
Des efforts vigoureux en nanotechnologie sont en cours pour concevoir des véhicules stables et efficaces pour le transfert de gènes aux cellules cancéreuses. En raison de leurs propriétés physicochimiques uniques, un certain nombre de nanomatériaux ont émergé pour la délivrance de gènes. Parmi eux, les nanoparticules d'or (Au NPs) avec des propriétés de taille et de surface spécifiques peuvent surmonter les obstacles in vivo pour devenir l'un des systèmes porteurs de gènes les plus étudiés. Cependant, ces stratégies ont rencontré diverses lacunes et il est donc important d'établir des systèmes d'administration efficaces ou des thérapies géniques améliorées et contrôlées.
Auto-assemblage et test de nanostructures de type tournesol
Dans le travail present, Huo et al. ont été inspirés par la capacité de la nature à hybrider l'ADN en manipulant l'ADN, nanostructures d'ADN d'or auto-assemblées (environ 200 nm). La conception en forme de tournesol a montré de fortes propriétés d'absorption NIR et de conversion photothermique. Lors d'une irradiation NIR, les structures démontées pour libérer des nanoparticules d'or ultra-petites (2 nm, Au NPs) avec un potentiel de silençage oncogène, une perméabilité des cellules et des noyaux améliorée et une efficacité de transfection améliorée. Les scientifiques ont contrôlé de manière synergique les interactions cellule-nanomatériau en fonction du temps de pré-incubation en laboratoire, suivi du temps de circulation in vivo et de la chronologie de l'irradiation. Les expériences ont facilité une absorption cellulaire accrue, efficacité de silençage génique réglable et inhibition tumorale contrôlée. Les nanotournesols transformables ont fourni un excellent modèle pour concevoir des nanovéhicules pour l'administration de médicaments avec un grand potentiel en biomédecine.
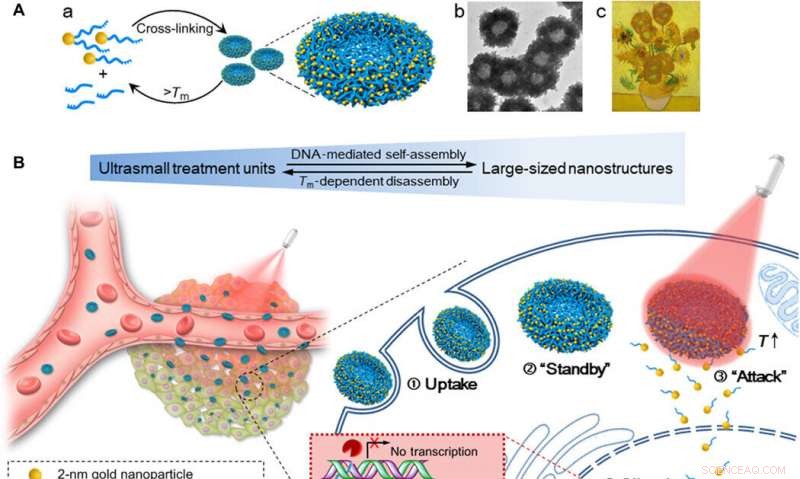
Caractérisation morphologique des nanostructures auto-assemblées (nanosunflowers). (A) images TEM (200 kV) des nanotournesols avec des détails structurels agrandis. (B) Images Bio-TEM (80 kV) avec des détails structurels de polymère agrandis. (C) Images MET haute résolution (200 kV) montrant la distribution des ultrapetites NP sur la nanostructure auto-assemblée. (D) Images SEM avec topographie de surface agrandie des nanotournesols. Crédit :Avancées scientifiques, doi:10.1126/sciadv.aaw6264
Huo et al. ont d'abord synthétisé les NP Au de deux nanomètres recouvertes de tiopronine et les ont modifiées avec des thiol-oligonucléotides (SH-POY2T) en utilisant une méthode établie d'échange de ligands. L'oligonucléotide POY2T de 23 nucléotides (nt) s'est lié au promoteur P2 de l'oncogène c-myc pour former une structure triplex et réguler à la baisse l'expression oncogène de c-myc. En parallèle, ils ont conçu et synthétisé une autre séquence simple brin connue sous le nom de CA pour s'hybrider de manière complémentaire à la queue de la séquence POY2T et bloquer sa liaison à l'oncogène c-myc. En complément, la nanostructure s'est auto-assemblée en structures de type tournesol. L'équipe a étudié la nanostructure (200 nm) en utilisant la microscopie électronique à transmission (MET). Une imagerie supplémentaire a révélé d'autres détails sur les fragments d'ADN de la structure "tournesol". Lorsque les scientifiques des matériaux ont utilisé la microscopie électronique à balayage (MEB) pour valider les résultats MET, ils ont observé une cohérence entre les méthodes.
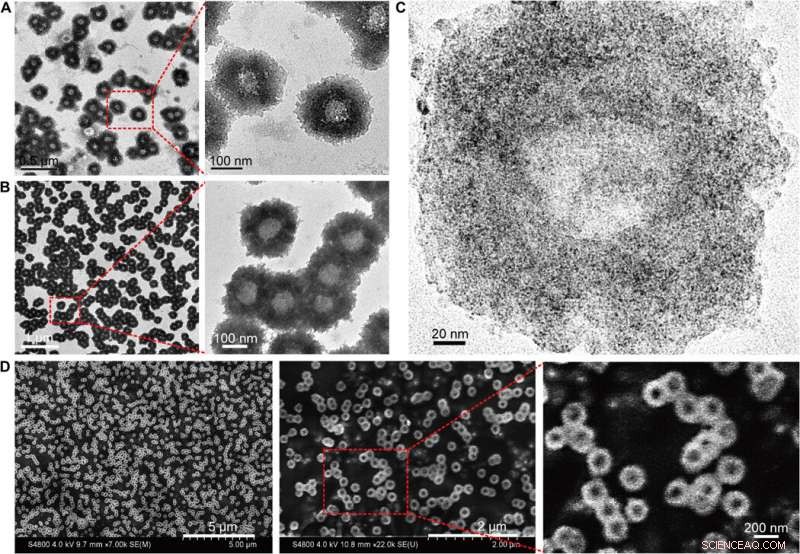
Ils ont étudié les spectres d'absorption UV-Vis des NPs Au ultrapetites avant l'auto-assemblage médié par l'ADN. Les monodispersés, Les NP Au-POY2T individuelles de deux nanomètres ont montré une forte absorption dans la région NIR pour générer de la chaleur sous irradiation NIR. Huo et al. crédité la forte absorbance NIR observée pour fermer l'espacement interparticulaire et la distribution spatiale non uniforme des NP individuelles au sein de la plus grande nanostructure. Ils ont testé la réponse thermique des nanostructures auto-assemblées sous irradiation NIR et ont noté le point de fusion des séquences d'ADN complémentaires (POY2T et CA) à environ 41 degrés C, dissocier la moitié de la structure duplex entre des séquences d'ADN complémentaires. Huo et al. sélectionné 10 minutes comme le temps optimal pour l'irradiation NIR dans l'étude.
Etude des propriétés photothermiques et du comportement de désassemblage des nanostructures auto-assemblées. (A) Spectres d'absorption visible de NP de la taille d'un noyau de 2 nm et de nanostructures auto-assemblées de 200 nm. a.u., unité d'absorption. (B) Réponse en température des nanostructures auto-assemblées, sous irradiation NIR, dispersé dans l'eau et le milieu de culture cellulaire. Valeurs moyennes ± SD, n =3. (C) Montée en température des nanostructures auto-assemblées, sous irradiation NIR, dispersé dans l'eau et le milieu de culture cellulaire. (D) Modification de l'absorbance maximale (767 nm) des NP de la taille d'un noyau de 2 nm et des nanostructures auto-assemblées de 200 nm lors d'une irradiation NIR. (E et F) Observation MET du comportement de désassemblage de nanostructures auto-assemblées de 200 nm avant (en haut) et après (en bas) l'irradiation NIR (808 nm, 10 minutes). (G) Diamètre hydrodynamique de (a) NPs Au-POY2T monodispersées de 2 nm et changement de taille des nanotournesols de 200 nm avant (b) et après (c et d) irradiation NIR pendant différentes périodes (3 et 10 min). Crédit :Avancées scientifiques, doi:10.1126/sciadv.aaw6264 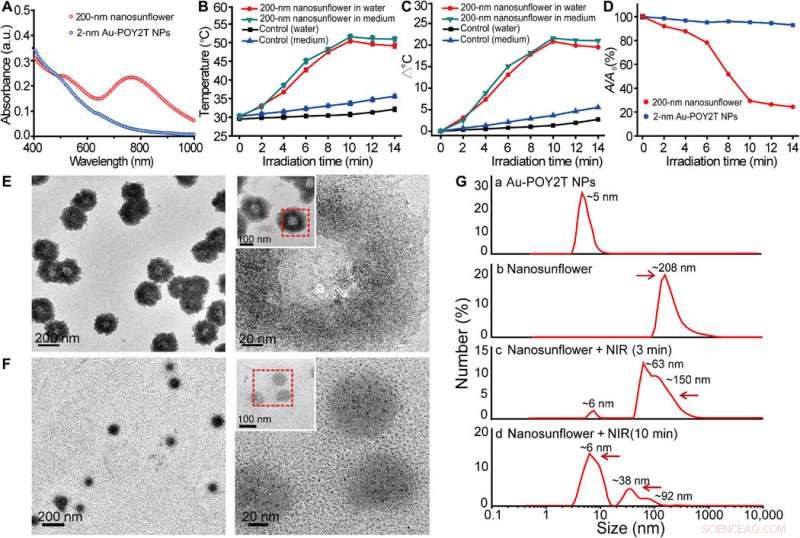
Les scientifiques ont émis l'hypothèse que les nanostructures auto-assemblées se rétracteraient et se désassembleraient en nanoparticules ultra petites individuelles Au-POY2T. Après 10 minutes d'irradiation NIR, l'absorption maximale (767 nm) des nanostructures a nettement diminué pour désassembler la structure du tournesol. Ils ont suivi les expériences avant et après l'irradiation NIR avec des observations MET et ont utilisé des analyseurs de taille de particules pour comprendre le processus de désassemblage et la transformation de la taille des nanostructures jusqu'à six nanomètres et ont confirmé l'adéquation optimale de la chronologie de 10 minutes.
Huo et al. appliqué l'irradiation NIR à des cellules MCF-7 traitées avec des nanostructures d'ADN en or auto-assemblées et testé leur absorption cellulaire in vitro comme preuve de concept. Ils ont déterminé l'internalisation cellulaire d'Au-POY2T (2 nm) sur diverses durées d'incubation et quantifié leur absorption cellulaire à l'aide de la spectroscopie de masse à plasma à couplage inductif (ICP-MS) et de méthodes antérieures. Ils ont noté une internalisation accrue après six heures d'incubation par rapport aux délais d'incubation de 24 heures. Ils n'ont pas observé d'inhibiteurs de l'endocytose pour influencer l'absorption de Au-POY2T NP, suggérant l'implication d'une voie alternative telle que la fusion membranaire.
Comprendre le comportement de silençage génique des nanostructures auto-assemblées
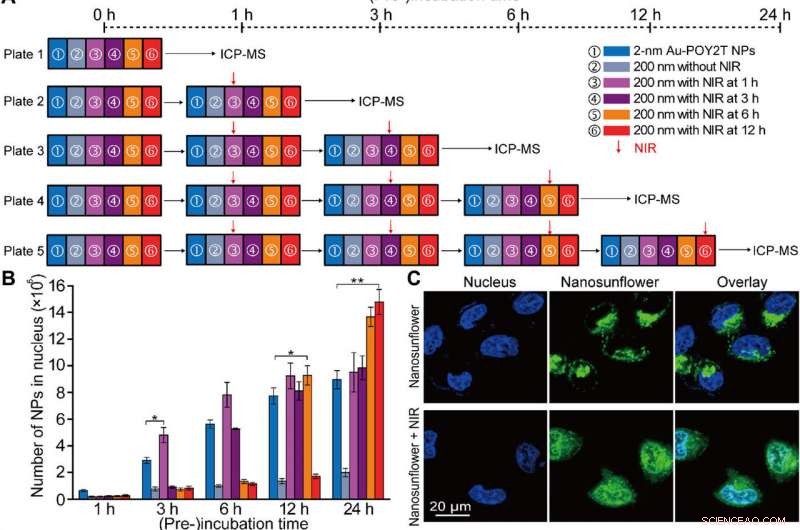
Etude de localisation contrôlée du noyau et de silençage génique in vitro des nanostructures auto-assemblées. (A) Schéma de la configuration expérimentale cellulaire in vitro pour l'étude de la localisation contrôlée du noyau NP et de la régulation des gènes. (B) Nombre de NP Au-POY2T 2 nm localisées dans le noyau cellulaire MCF-7 avec traitement de ① NP Au-POY2T 2 nm individuelles, ② nanotournesols 200 nm, et des nanotournesols 200 nm avec irradiation NIR (10 min) après différents temps de pré-incubation (③ 1, 3, 6, et ⑥ 12 heures). Valeurs moyennes ± SD, n =3. Les différences statistiques ont été déterminées par le test t de Student bilatéral ; *P <0,05 et **P <0,01. (C) Observation confocale de la distribution des nanotournesols marqués à l'isothiocyanate de fluorescéine (vert) avant (en haut) et après (en bas) l'irradiation NIR dans les cellules MCF-7. Le noyau était étiqueté par 4′, 6-diamidino-2-phénylindole (bleu). (D) Image Bio-TEM de la localisation de nanotournesols de grande taille (en haut, flèche rouge) dans le cytoplasme et distribution des petites NP libérées (en bas, flèche bleue) dans le cytoplasme et le noyau après irradiation NIR dans les cellules MCF-7. (E) Évaluation de la cytotoxicité des cellules MCF-7 avec traitement de nanotournesols 200 nm après irradiation NIR (après une période de préincubation :1, 3, 6, et 12 heures, respectivement) par rapport au témoin, NPs Au-TIOP 2 nm, séquence POY2T, séquence CA, NPs Au-POY2T 2 nm, nanotournesols 200 nm sans irradiation NIR, et exposition NIR uniquement. Toutes les concentrations de traitements étaient égales ou égales à 1 µM en séquence POY2T et ont été testées après un total de 24 heures d'incubation. Valeurs moyennes ± SD, n =3. Les différences statistiques ont été comparées avec le groupe de traitement de ① NP Au-POY2T individuelles à 2 nm déterminées par le test t de Student bilatéral ; *P <0,05 et **P <0,01. (F) Niveau d'ARNm de C-myc déterminé par PCR en temps réel après différents traitements comme décrit ci-dessus. Valeurs moyennes ± SD, n =3. Les différences statistiques ont été déterminées par le test t de Student bilatéral ; **P <0,01 et ***P <0,001. (G) niveaux de protéine C-myc déterminés par Western blot et (H) histogramme quantitatif correspondant après différents traitements comme décrit ci-dessus. GAPDH, la glycéraldéhyde phosphate déshydrogénase. Crédit :Avancées scientifiques, doi:10.1126/sciadv.aaw6264
Après une absorption cellulaire améliorée de nanostructures auto-assemblées in vitro, l'équipe de recherche a étudié la distribution des nanoparticules dans les noyaux cellulaires en utilisant des stratégies de « veille » et « d'attaque » après le déclenchement du NIR. Pour ça, ils ont extrait les noyaux cellulaires après incubation, pour l'analyse ICP-MS après irradiation NIR sur diverses périodes d'incubation (une, Trois, six et 12 heures). Ils ont noté que la période de pré-incubation affecte largement l'internalisation des nanoparticules dans le noyau cellulaire, et les chercheurs ont régulé les NP Au-POY2T dans le noyau cellulaire en fonction du temps de pré-incubation et de l'irradiation NIR.
Huo et al. ont également étudié les effets thérapeutiques contrôlés par irradiation NIR des nanotournesols à l'aide de tests de viabilité cellulaire; ils ont observé que le silençage des oncogènes augmentait considérablement (80 %) et tuait davantage de cellules cancéreuses. L'équipe de recherche a contrôlé efficacement l'impact thérapeutique en modifiant efficacement la chronologie de la pré-incubation et de l'irradiation. Les résultats ont confirmé une capacité supérieure des nanotournesols transformables à faire taire l'oncogène et l'oncoprotéine c-myc. Les scientifiques ont contrôlé le processus de silençage génique en ajustant les délais de pré-incubation avant l'irradiation NIR.
Contrôler l'inhibition de la croissance tumorale à l'aide de nanotournesols auto-assemblés
Tester l'efficacité anti-tumorale contrôlable des nanotournesols in vivo, les scientifiques ont d'abord étudié leur compatibilité sanguine pour confirmer une bonne biocompatibilité sanguine. L'équipe de recherche a ensuite établi le modèle tumoral MCF-7 en utilisant les souris nudes BALB/c, a permis aux volumes tumoraux d'atteindre 50 mm 3 et divisé au hasard les animaux en neuf groupes et les a traités avec 1000 µl de diverses formulations de POY2T. Après chaque injection, ils ont irradié les groupes d'animaux avec des lasers NIR pendant 10 minutes pour atteindre une température locale supérieure à 41 degrés C.
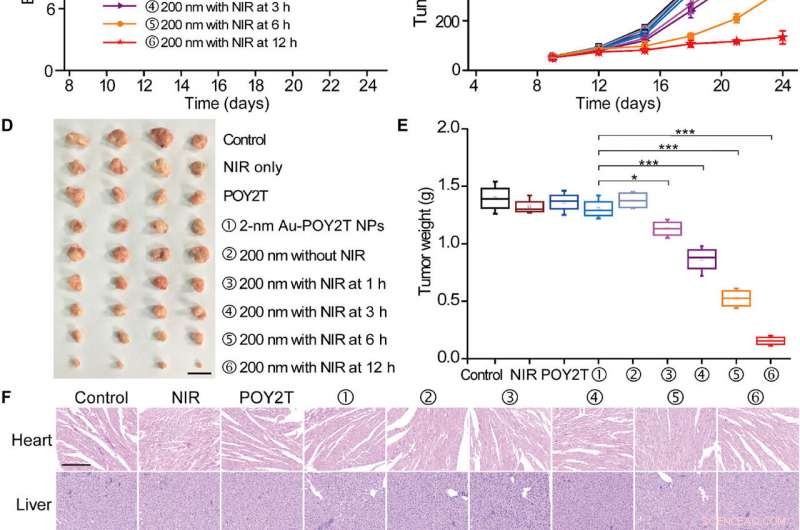
Etude d'inhibition de la croissance tumorale contrôlée des nanostructures auto-assemblées. (A) Le modèle de souris nude BALB/c de tumeur MCF-7 a été établi au jour 0. Une fois les tumeurs prêtes, les souris ont été réparties au hasard en neuf groupes et traitées avec 100 l de diverses formulations (équivalent à 10 M dans la séquence POY2T ; groupe avec 2 nm Au-POY2T NPs et groupes ②, , , , et ⑥ avec des nanotournesols de 200 nm) aux jours 9, 12, et 15. Dans les groupes , , , et , les tumeurs ont été irradiées avec un laser NIR pendant 10 min à 1, 3, 6, et 12 heures après chaque injection intraveineuse. Saline, NIR uniquement, et POY2T ont été utilisés comme groupes témoins. Les poids corporels (B) et (C) les volumes tumoraux ont été mesurés tous les 3 jours. Barre d'échelle, 1cm. Après le sacrifice des souris au jour 24, toutes les tumeurs ont été (D) isolées et (E) pondérées, respectivement. Valeurs moyennes ± SD, n =4. Les différences statistiques ont été déterminées par le test t de Student bilatéral ; *P <0,05, **P <0,01, et ***P <0,001. (Crédit photo :Ningqiang Gong, Centre national des nanosciences et technologies, Chine.) (F) Images de coloration à l'hématoxyline et à l'éosine d'organes, y compris le cœur, le foie, rate, poumon, un rein, et tumeur après différents traitements. Barre d'échelle, 200 µm. Crédit :Avancées scientifiques, doi:10.1126/sciadv.aaw6264
A noter, les souris traitées avec le groupe traité au nanotournesol et irradiées à 12 heures ont montré les effets anti-tumoraux les plus significatifs, indiquant une délivrance efficace d'unités de silençage génique dans le site tumoral. Après 24 jours, Huo et al. sacrifié les animaux, ont isolé les tumeurs et les ont pesées pour démontrer l'inhibition de la croissance tumorale contrôlée par NIR à base de nanotournesol in vivo. Sur la base d'études histologiques, l'équipe a montré que le traitement réduisait considérablement la croissance tumorale et n'affectait pas la morphologie des autres organes. Les résultats ont vérifié l'efficacité thérapeutique et l'absence d'effets secondaires pour les nanotournesols et la thérapie NIR.
De cette façon, Shuaidong Huo et ses collègues ont conçu, nanoagents développés et optimisés pour une thérapie anti-tumorale efficace. Ils ont conçu des nanostructures de type tournesol auto-assemblées pour agir comme des supports multiparticulaires chargés de nombreuses unités thérapeutiques ultra petites. Lors d'une irradiation NIR, les nanostructures se sont dissociées pour libérer des essaims de petites NP pour cibler le noyau cellulaire. Chez les souris porteuses de tumeurs, les gros tournesols ont ciblé passivement le site de la tumeur, suivi d'une irradiation NIR pour transformer la composition génétique de la tumeur et la réduire. L'équipe de recherche vise à améliorer l'efficacité de la transfection et à fournir un modèle pour un silençage génique contrôlable au niveau des sites tumoraux à l'aide de porteurs d'interférence génique transformables pour une théranostique complexe au niveau de la cellule unique.
© 2019 Réseau Science X