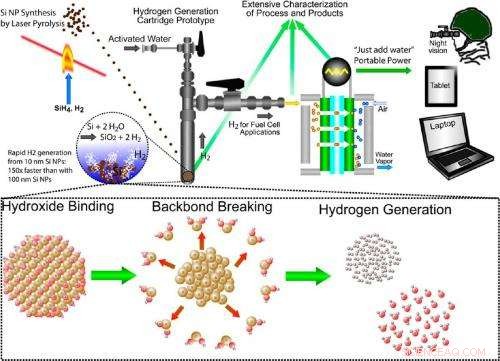
Illustration de l'approche pluridisciplinaire de production d'hydrogène par oxydation du silicium. L'approche consiste à synthétiser des nanoparticules de silicium, la réaction silicium-eau qui génère de l'hydrogène à la demande, et l'utilisation de l'hydrogène dans une pile à combustible pour l'alimentation portable. Crédit :Folarin Erogbogbo, et al. ©2013 Société chimique américaine
(Phys.org)—Bien que les scientifiques sachent que lorsque le silicium se mélange à l'eau, l'hydrogène est produit par oxydation, personne ne s'attendait à la rapidité avec laquelle les nanoparticules de silicium pourraient effectuer cette tâche. Comme l'a révélé une nouvelle étude, Les nanoparticules de silicium de 10 nm peuvent générer de l'hydrogène 150 fois plus rapidement que les nanoparticules de silicium de 100 nm, et 1, 000 fois plus rapide que le silicium en vrac. La découverte pourrait ouvrir la voie à des technologies rapides de génération d'hydrogène « il suffit d'ajouter de l'eau » pour les appareils portables sans avoir besoin de lumière, Chauffer, ou l'électricité.
Les chercheurs, Folarin Erogbogbo à l'Université de Buffalo et coauteurs, ont publié leur article sur l'utilisation du nanosilicium pour générer de l'hydrogène dans un récent numéro de Lettres nano .
Si l'hydrogène doit un jour être utilisé pour fournir de l'énergie pour de larges applications commerciales, l'une des exigences est de trouver un rapide, moyen peu coûteux de produire de l'hydrogène. L'une des techniques de production d'hydrogène les plus courantes consiste à diviser l'eau en hydrogène et oxygène. Il existe plusieurs façons de diviser l'eau, comme avec un courant électrique (électrolyse), Chauffer, lumière du soleil, ou une substance qui réagit chimiquement avec l'eau. Ces substances comprennent l'aluminium, zinc, et silicium.
Comme les scientifiques l'ont expliqué, les réactions d'oxydation silicium-eau ont été jusqu'à présent lentes et non compétitives avec d'autres techniques de fractionnement de l'eau. Cependant, le silicium a des avantages théoriques, comme être abondant, étant facile à transporter, et ayant une densité d'énergie élevée. Plus loin, lors de l'oxydation avec de l'eau, le silicium peut théoriquement libérer deux moles d'hydrogène par mole de silicium, soit 14 % de sa propre masse en hydrogène.
Pour ces raisons, les scientifiques ont décidé d'examiner de plus près le silicium, spécifiquement des nanoparticules de silicium, qui n'ont pas été étudiés auparavant pour la production d'hydrogène. Parce que les nanoparticules de silicium ont une plus grande surface que les particules plus grosses ou le silicium en vrac, on s'attendrait à ce que les nanoparticules puissent générer de l'hydrogène plus rapidement que les plus gros morceaux de silicium.
Mais les améliorations que les scientifiques ont découvertes avec les nanoparticules de silicium ont largement dépassé leurs attentes. La réaction de particules de silicium de 10 nm avec de l'eau a produit un total de 2,58 mol d'hydrogène par mol de silicium (dépassant même les attentes théoriques), 5 secondes pour produire 1 mmol d'hydrogène. En comparaison, la réaction avec des particules de silicium de 100 nm a produit un total de 1,25 mole d'hydrogène par mole de silicium, prendre 811 secondes pour produire chaque mmol d'hydrogène. Pour le silicium en vrac, la production totale n'était que de 1,03 mole d'hydrogène par mole de silicium, prendre 12,5 heures complètes pour produire chaque mmol d'hydrogène. Pour une comparaison des taux, le silicium à 10 nm générait de l'hydrogène 150 fois plus vite que le silicium à 100 nm et 1, 000 fois plus rapide que le silicium en vrac.
"Je crois que la plus grande importance de ce travail est la démonstration que le silicium peut réagir avec l'eau assez rapidement pour être utile dans la pratique pour la production d'hydrogène à la demande, " co-auteur Mark Swihart, Professeur de génie chimique et biologique à l'Université de Buffalo, Raconté Phys.org . "Ce résultat était à la fois inattendu et d'une importance pratique potentielle. Bien que je ne pense pas que l'oxydation des nanoparticules de silicium deviendra de si tôt une méthode réalisable pour la génération d'hydrogène à grande échelle, ce processus pourrait être très intéressant pour les applications portables à petite échelle où l'eau est disponible."

Une comparaison des taux de génération d'hydrogène pour différentes formes de silicium. Les taux maximums sont dans la colonne de gauche avec des images des échantillons dessus. Les taux moyens sont dans la colonne de droite. La ligne rouge indique le taux maximal signalé pour l'hydrogène généré à partir de l'aluminium. Crédit :Folarin Erogbogbo, et al. ©2013 Société chimique américaine
En plus de produire de l'hydrogène plus rapidement que les plus gros morceaux de silicium, le silicium à 10 nm produit également de l'hydrogène beaucoup plus rapidement que les nanoparticules d'aluminium et de zinc. Comme Swihart l'a expliqué, l'explication de cette inégalité diffère pour les deux matériaux.
"Par rapport à l'aluminium, le silicium réagit plus rapidement car l'aluminium forme un oxyde plus dense et plus robuste (Al
Bien que la plus grande surface du silicium de 10 nm par rapport aux morceaux de silicium plus gros contribue à son taux de production d'hydrogène rapide, la superficie à elle seule ne peut expliquer l'énorme augmentation du taux observée par les scientifiques. La surface du silicium 10 nm est de 204 m 2 /g, environ 6 fois plus grande que la surface du silicium 100 nm, qui fait 32 m 2 /g.
Pour comprendre ce qui cause l'augmentation beaucoup plus importante du taux de production d'hydrogène, les chercheurs ont mené des expériences pendant le processus de gravure du silicium. Ils ont trouvé que, pour les particules de 10 nm, la gravure implique la suppression d'un nombre égal de plans de réseau dans chaque direction (gravure isotrope). En revanche, pour les particules et microparticules de 100 nm, des nombres inégaux de plans de réseau sont supprimés dans chaque direction (gravure anisotrope).
Les chercheurs attribuent cette différence de gravure aux différentes géométries de cristaux de tailles différentes. En raison de cette différence, les particules plus grosses adoptent des formes non sphériques qui exposent des surfaces moins réactives par rapport aux particules plus petites, qui restent presque sphériques, exposer toutes les facettes du cristal pour la réaction. Les particules plus grosses développent également des couches plus épaisses de sous-produits de silicium oxydé à travers lesquels l'eau doit diffuser. Ces deux facteurs limitent la vitesse de la réaction sur des particules plus grosses.
Pour confirmer que la réaction silicium-eau à 10 nm génère de l'hydrogène sans sous-produits susceptibles d'interférer avec les applications, les chercheurs ont utilisé l'hydrogène généré par le silicium pour faire fonctionner une pile à combustible. La pile à combustible a très bien fonctionné, produisant plus de courant et de tension que la quantité théorique d'hydrogène pur, ce qui est dû au fait que les particules de 10 nm ont généré plus d'hydrogène que les 14 % en poids théoriques.
Les chercheurs espèrent que cette capacité surprenante des nanoparticules de silicium à diviser rapidement l'eau et à générer de l'hydrogène pourrait conduire au développement d'une technologie d'hydrogène à la demande qui pourrait permettre l'utilisation de piles à combustible dans des appareils portables. Cette technologie nécessiterait une grande échelle, méthode écoénergétique de production de nanoparticules de silicium, mais pourrait présenter certains avantages par rapport à d'autres techniques de génération d'hydrogène.
« Le principal avantage de l'oxydation du silicium pour la production d'hydrogène est sa simplicité, " a déclaré Swihart. " Avec cette approche, l'hydrogène est produit rapidement, à température ambiante, et sans avoir besoin d'aucune source d'énergie externe. L'énergie nécessaire à la production d'hydrogène est effectivement stockée dans le silicium. Tout l'apport énergétique nécessaire à la production du silicium peut être fourni à un emplacement central, et le silicium peut alors être utilisé dans des applications portables.
"Le principal inconvénient de l'oxydation du silicium est sa relative inefficacité. L'apport d'énergie nécessaire pour créer les nanoparticules de silicium est bien supérieur à l'énergie disponible à partir de l'hydrogène qui est finalement produit. Pour les applications à grande échelle, ce serait un problème. Pour les applications portables, ce n'est pas. Par exemple, le coût de l'électricité fournie par une batterie domestique ordinaire peut facilement être 10 à 100 fois plus élevé que le coût de l'électricité d'un service public, mais les batteries jouent toujours un rôle important dans nos vies."
À l'avenir, les chercheurs prévoient d'augmenter encore la capacité de génération d'hydrogène de l'oxydation du silicium en expérimentant différents mélanges.
"Une direction que nous poursuivons actuellement est l'utilisation de mélanges de nanoparticules de silicium avec des hydrures métalliques, qui réagissent également avec l'eau pour produire de l'hydrogène, " a déclaré Swihart. " Des composés comme l'hydrure de lithium et l'hydrure de sodium réagissent avec l'eau pour produire la base (LiOH ou NaOH) qui est nécessaire pour catalyser l'oxydation du silicium. Cependant, ils peuvent réagir trop vite avec l'eau (explosivement) et ne sont pas stables dans l'air. Les mélanger avec des nanoparticules de silicium ou les enrober de nanoparticules de silicium peut servir à la fois à tempérer leur réactivité et à augmenter la capacité de génération d'hydrogène du système en remplaçant la base ajoutée (par exemple, KOH dans l'article publié) avec un matériau qui génère également de l'hydrogène."
Copyright 2013 Phys.org
Tous les droits sont réservés. Ce matériel ne peut pas être publié, diffuser, réécrit ou redistribué en tout ou en partie sans l'autorisation écrite expresse de Phys.org.