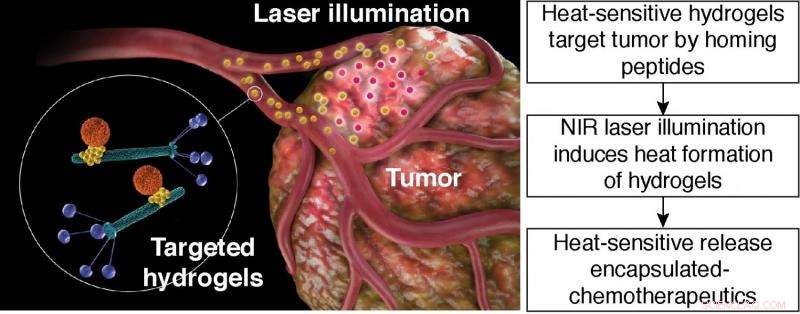
Libération thermosensible de produits chimiothérapeutiques encapsulés. Illustration schématique de la thérapie photothermique hydrogel ciblée. Hydrogel ciblé :particule orange, nanosupport à base de liposomes; particule jaune, nanoparticule d'or; tiges vertes, particules de bactériophage avec des ligands peptidiques affichés sur la protéine de revêtement du phage (bleu). Crédit :Hosoya, et al.
(Phys.org) - Les nanoparticules fonctionnalisées sont une voie d'administration de médicaments pour la chimiothérapie. Cependant, obtenir des nanoparticules pour cibler le site tumoral s'est avéré difficile à faire. Une méthode que les chercheurs ont utilisée pour cibler les cellules cancéreuses consiste à créer des hydrogels constitués de bactériophage filamenteux (phage) et de nanoparticules d'or. Des ligands de liaison peptidique peuvent être incorporés dans la partie phage de l'hydrogel qui ciblera ensuite les cellules de carcinome connues.
Un groupe interdisciplinaire de chercheurs de diverses universités au Japon, les Etats Unis., et l'Allemagne ont développé une plateforme d'hydrogel qui peut cibler les tumeurs, fournir une imagerie non invasive, et libérer un médicament chimiothérapeutique. Ils ont démontré leur plate-forme dans des études in vitro et dans des modèles murins. En outre, ils démontrent que leur plateforme est généralisable à différentes cibles et chimiothérapies. Leur travail apparaît dans le Actes de l'Académie nationale des sciences .
Hosoya, La plate-forme d'hydrogel de et al. se compose de bactériophage, nanoparticules d'or, et des supports de taille nanométrique tels que des liposomes ou des particules de silice mésoporeuses. Dans ce cadre, les particules de phage sont capables de reconnaître des molécules spécifiques sur les cellules tumorales. Les nanoparticules d'or servent de « rapporteur » pour la distribution de l'hydrogel. Le nanocarrier transporte divers produits chimiques ou marchandises pharmaceutiques. Le nanotransporteur libère la cargaison lors d'un stimulus spécifique, comme la chaleur.
Dans les travaux en cours, Hosoya, et al. a d'abord prouvé que les liposomes thermosensibles (HSL) serviraient de formidable support thermosensible. En théorie, alors que la LGV commence à fondre, il libère le médicament qui y est incorporé. En utilisant la calcéine, une molécule fluorescente active, ils ont déterminé que la HSL libérait de la calcéine lorsqu'elle atteignait 40 o C, comme prédit. Lorsque le HSL a été laissé à une température constante (42 o C), il a libéré toute la calcéine en 10 minutes. Hosoya, et al. ont ensuite prouvé que ces HSL étaient toujours sensibles aux changements de température lorsqu'elles étaient incorporées dans la plate-forme d'hydrogel.
L'étape suivante consistait à démontrer que les hydrogels contenant de la HSL répondaient au chauffage NIR à l'intérieur d'une matrice. Les auteurs ont utilisé le gel d'agarose comme système modèle. Ils ont découvert que l'hydrogel contenant de la HSL répondait au chauffage NIR et que la puissance du laser augmentait, la température de l'hydrogel augmente. Ils ont ensuite déterminé si le chauffage NIR déclencherait la libération de doxorubicine (dox), une chimiothérapie. Ils ont pu produire une « augmentation de l'intensité de fluorescence en fonction de la dose de photons reproductible et robuste ».
Pour déterminer la répartition de la chaleur dans l'hydrogel à partir du NIR, ils ont utilisé l'imagerie par résonance magnétique de la température sur les hydrogels contenant de la HSL sur la plate-forme d'agarose. Les images de gradient thermique ont confirmé que la chaleur centralisée était produite par l'hydrogel via le laser NIR. Ils ont utilisé des hydrogels contenant de la HSL encapsulés dans du gadolinium pour confirmer que la libération du médicament s'était produite à l'emplacement du faisceau laser.
Bien que ces résultats montrent que la libération du médicament peut être contrôlée à l'aide du NIR, ils doivent encore tester si le système peut cibler le site du cancer. Pour faire ça, Hosoya, et al ont incorporé un ligand qui a un peptide cyclique bien établi qui se lie à CRKL. Les particules de phage se liant à CRKL ciblent EF43. fgf-4 cellules de carcinome mammaire. En utilisant des hydrogels contenant de la HSL marqués à la rhodamine, ils ont démontré que le phage ciblait les cellules du carcinome, confirmant qu'il conserve toujours ses propriétés de liaison même lorsqu'il est incorporé dans la nanoplateforme.
Ils ont ensuite effectué des tests in vivo sur des souris. Ils ont suivi l'emplacement et les effets de leur plate-forme d'hydrogel contenant de la HSL chez des souris qui avaient EF43. fgf-4 carcinome mammaire. Des études d'imagerie par fluorescence optique ont montré que la tumeur était visible chez les souris traitées avec le système d'hydrogel ciblé par rapport aux témoins. L'analyse des tumeurs après 24 h a révélé que les nanoparticules d'or, phage ciblé, et les HSL étaient situées à l'intérieur de la tumeur. Des études supplémentaires pour voir si leur système pouvait ensuite libérer une chimiothérapie utilisant le NIR sur le site de la tumeur se sont également avérées fructueuses. Les auteurs ont observé une croissance tumorale réduite chez les souris avec des hydrogels contenant de la HSL avec dox, et ont confirmé leurs résultats en utilisant la modélisation mathématique.
Finalement, tester la polyvalence de leur nanoplateforme d'hydrogel, Hosoya, et al. incorporé des nanoparticules de silice mésoporeuses (MSNP) dans le système d'hydrogel. Les propriétés chimiques de MSNP permettent d'emballer différents produits chimiothérapeutiques. Ils ont testé si les hydrogels contenant du MSNP pouvaient délivrer du FITC dans deux modèles de cancer différents, le même modèle de cancer du sein utilisé précédemment (EF43. fgf-4 ) et un modèle pour le cancer de la prostate. Ils ont trouvé une liaison ciblée aux deux cancers et des études avec dox ont montré une diminution de la taille de la tumeur.
Ce travail démontre une plate-forme d'hydrogel qui ne modifie pas les propriétés physiques ou chimiques des systèmes de nanosupports connus tels que les liposomes thermosensibles ou les nanoparticules de silice mésoporeuses. Cette plateforme permet de cibler, livraison induite par la chaleur, et est à la fois polyvalent et reproductible. Avec des études complémentaires, ce système pourrait être un général, méthode robuste pour l'administration ciblée de médicaments.
© 2016 Phys.org