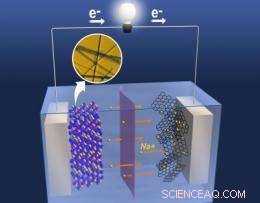
La nanostructure uniforme de l'oxyde de manganèse traité thermiquement fournit des tunnels pour le passage des ions sodium, améliorer les performances des électrodes. Crédit :PNNL
(PhysOrg.com) -- En ajoutant la bonne quantité de chaleur, des chercheurs ont mis au point une méthode qui améliore la capacité électrique et la durée de vie de recharge des batteries rechargeables aux ions sodium, ce qui pourrait être une alternative moins chère pour des utilisations à grande échelle telles que le stockage d'énergie sur le réseau électrique.
Pour connecter les sources d'énergie solaire et éolienne au réseau électrique, les gestionnaires de réseau ont besoin de batteries capables de stocker de grandes quantités d'énergie créée à la source. Les batteries rechargeables au lithium-ion - courantes dans l'électronique grand public et les véhicules électriques - fonctionnent bien, mais sont trop chères pour une utilisation généralisée sur le réseau car de nombreuses batteries seront nécessaires, et ils devront probablement être grands. Le sodium est le prochain meilleur choix, mais les batteries sodium-soufre actuellement utilisées fonctionnent à des températures supérieures à 300 degrés Celsius, ou trois fois la température de l'eau bouillante, ce qui les rend moins écoénergétiques et sûres que les batteries qui fonctionnent à température ambiante.
Les développeurs de batteries veulent le meilleur des deux mondes :utiliser à la fois du sodium bon marché et le type d'électrodes que l'on trouve dans les batteries rechargeables au lithium. Une équipe de scientifiques du laboratoire national du Pacifique Nord-Ouest du ministère de l'Énergie et des chercheurs invités de l'Université de Wuhan à Wuhan, La Chine a utilisé des nanomatériaux pour fabriquer des électrodes qui peuvent fonctionner avec du sodium, ils ont rapporté le 3 juin en ligne dans le journal Matériaux avancés .
"La batterie sodium-ion fonctionne à température ambiante et utilise des ions sodium, un ingrédient du sel de cuisine. Ce sera donc beaucoup moins cher et plus sûr, " a déclaré le chimiste du PNNL Jun Liu, qui a co-dirigé l'étude avec le chimiste de l'Université de Wuhan, Yuliang Cao.
Les électrodes des rechargeables au lithium qui intéressent les chercheurs sont en oxyde de manganèse. Les atomes de cet oxyde métallique forment de nombreux trous et tunnels que les ions lithium traversent lorsque les batteries sont chargées ou utilisées. La libre circulation des ions lithium permet à la batterie de retenir l'électricité ou de la libérer dans un courant. Mais le simple remplacement des ions lithium par des ions sodium est problématique - les ions sodium sont 70 % plus gros que les ions lithium et ne rentrent pas non plus dans les crevasses.
Pour trouver un moyen de faire des trous plus gros dans l'oxyde de manganèse, Les chercheurs du PNNL sont allés beaucoup plus petit. Ils se sont tournés vers les nanomatériaux - des matériaux fabriqués à l'échelle nanométrique, ou environ un million de fois plus mince qu'un centime - qui ont des propriétés surprenantes en raison de leur petitesse. Par exemple, les courtes distances que les ions sodium doivent parcourir dans les nanofils pourraient faire de l'oxyde de manganèse une meilleure électrode sans rapport avec la taille des tunnels.
Explorer, l'équipe a mélangé deux types différents de blocs de construction atomiques d'oxyde de manganèse - un dont les atomes s'organisent en pyramides, et un autre dont les atomes forment un octaèdre, une structure en forme de diamant à partir de deux pyramides collées ensemble à leurs bases. Ils s'attendaient à ce que le matériau final ait de grands tunnels en forme de S et de plus petits tunnels à cinq côtés à travers lesquels les ions pourraient s'écouler.
Après mélange, l'équipe a traité les matériaux à des températures allant de 450 à 900 degrés Celsius, puis examiné les matériaux et testé quel traitement fonctionnait le mieux. A l'aide d'un microscope électronique à balayage, l'équipe a découvert que différentes températures créaient un matériau de qualité différente. Le traitement de l'oxyde de manganèse à 750 degrés Celsius a créé les meilleurs cristaux :trop bas et les cristaux sont apparus floconneux, trop haut et les cristaux se sont transformés en plaques plates plus grandes.
Zoomer encore plus à l'aide d'un microscope électronique à transmission à l'EMSL, Laboratoire de Sciences Moléculaires Environnementales du DOE sur le campus du PNNL, l'équipe a vu que l'oxyde de manganèse chauffé à 600 degrés avait des marques dans les nanofils qui pourraient entraver les ions sodium, mais les fils traités à 750 degrés semblaient uniformes et très cristallins.
Mais même le matériau le plus beau n'est qu'une façade s'il ne fonctionne pas bien. Pour savoir s'il est à la hauteur de sa beauté, l'équipe du PNNL-Wuhan a plongé le matériau de l'électrode dans l'électrolyte, le liquide contenant des ions sodium qui vont aider les électrodes d'oxyde de manganèse à former un courant. Ensuite, ils ont chargé et déchargé les cellules de la batterie expérimentale à plusieurs reprises.
L'équipe a mesuré la capacité de pointe à 128 milliampères-heures par gramme de matériau d'électrode lorsque la cellule de batterie expérimentale se déchargeait. Ce résultat a dépassé les précédents obtenus par d'autres chercheurs, dont l'un a atteint une capacité maximale de 80 milliampères-heures par gramme pour des électrodes en oxyde de manganèse mais avec une méthode de production différente. Les chercheurs pensent que la capacité inférieure est due aux ions sodium provoquant des changements structurels dans cet oxyde de manganèse qui ne se produisent pas ou se produisent moins fréquemment dans le matériau nanométrique traité thermiquement.
En plus d'une grande capacité, le matériau a bien résisté aux cycles de charge et de décharge, comme cela se produirait dans l'utilisation par les consommateurs. De nouveau, le matériau traité à 750 Celsius a donné les meilleurs résultats :après 100 cycles de charge-décharge, il n'a perdu que 7 pour cent de sa capacité. Le matériau traité à 600 Celsius ou 900 Celsius a perdu environ 37 pour cent et 25 pour cent, respectivement.
Même après 1, 000 cycles, la capacité des électrodes traitées à 750 Celsius n'a baissé que d'environ 23 %. Les chercheurs ont pensé que le matériau fonctionnait très bien, conservant 77 % de sa capacité initiale.
Durer, l'équipe a chargé la cellule expérimentale à différentes vitesses pour déterminer à quelle vitesse elle pourrait consommer de l'électricité. L'équipe a constaté que plus elle la chargeait rapidement, moins il pourrait contenir d'électricité. Cela a suggéré à l'équipe que la vitesse à laquelle les ions sodium pouvaient se diffuser dans l'oxyde de manganèse limitait la capacité de la cellule de la batterie - lorsqu'elle est chargée rapidement, les ions sodium ne pouvaient pas entrer dans les tunnels assez vite pour les remplir.
Pour compenser les ions sodium lents, les chercheurs suggèrent à l'avenir de fabriquer des nanofils encore plus petits pour accélérer la charge et la décharge. Les batteries de réseau ont besoin d'une charge rapide afin de pouvoir collecter autant d'énergie nouvellement produite provenant de sources renouvelables que possible. Et ils doivent se décharger rapidement lorsque la demande augmente lorsque les consommateurs allument leurs climatiseurs et téléviseurs, et brancher leurs véhicules électriques à la maison.
De telles batteries hautement performantes pourraient réduire la chaleur d'un réseau électrique déjà taxé.