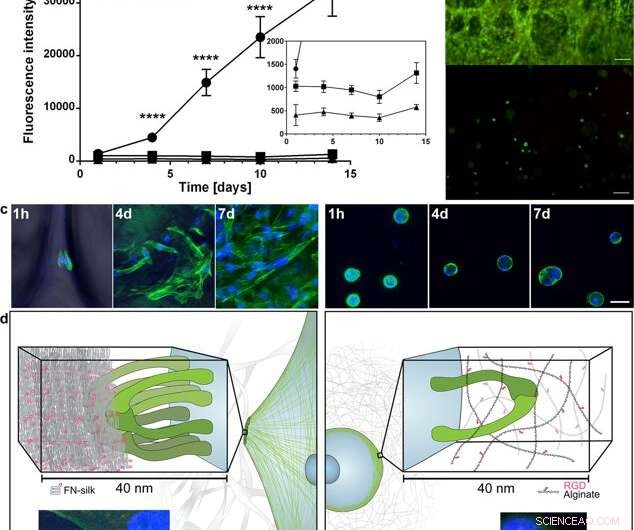
Propagation et expansion des cellules dans la soie FN par rapport à l'encapsulation dans un hydrogel couplé au RGD. (a) Graphique représentatif (moyenne et écart type) du test de viabilité Alamar Blue montrant l'activité métabolique des fibroblastes (HDF) dans la mousse de soie FN (cercle), un hydrogel d'alginate à très basse viscosité (VLVG) couplé à du RGD (carré), et un hydrogel d'alginate de viscosité moyenne (MVG) couplé à du RGD (triangle) pendant deux semaines de culture. L'insertion montre une vue agrandie des intensités inférieures. Statistiques (test t des étudiants à chaque instant) :**** indique p < 0,0001 (n = 12) (b) Coloration représentative vivante (verte) et morte (rouge) des cellules souches mésenchymateuses humaines (HMSC) dans FN- mousse de soie (supérieure) et alginate couplé RGD VLVG (inférieur) au jour 14. Barres d'échelle = 100 µm. (c) Scans confocaux de HMSC intégrés dans la mousse FN-soie (panneau de gauche), et l'hydrogel d'alginate couplé RGD MVG (panneau de droite) après 1 h, 4 jours et 7 jours. Les filaments d'actine sont visualisés par coloration à la phalloïdine (vert) et les noyaux cellulaires sont colorés au DAPI (bleu). Barres d'échelle = 20 µm. (d) Description schématique de l'hypothèse expliquant la raison de la différence observée dans les interactions entre les cellules et la soie (à gauche) par rapport aux hydrogels d'alginate couplés au RGD (à droite). Plusieurs paires d'intégrines (vertes) peuvent adhérer et se rassembler sur les microfibres de soie, former des adhérences focales au bord des filaments d'actine, permettant aux cellules de se propager et de proliférer. Dans l'hydrogel d'alginate, une seule paire d'intégrines (vert) peut se lier au motif RGD couplé, mais les fines chaînes d'alginate restreignent le rassemblement ultérieur en adhérences focales. Les inserts montrent des exemples d'une cellule (fibroblaste) après 3 h dans de la mousse de soie FN (à gauche) et un hydrogel d'alginate à faible viscosité (VLVG) couplé avec RGD (à droite). Les filaments d'actine sont visualisés par coloration à la phalloïdine (vert), et des adhérences focales peuvent être observées là où elles sont co-localisées avec une coloration pour la vinculine (rouge, marqué d'une flèche). Les noyaux cellulaires sont colorés au DAPI (bleu). Crédit :Rapports scientifiques, doi:10.1038/s41598-019-42541-y
Les tissus biologiques sont construits lorsque les cellules s'ancrent à des sites spécifiques sur un réseau de microfibres 3-D dans une matrice extracellulaire (ECM). Les scientifiques souhaitent recréer des tissus biologiques en laboratoire en utilisant le génie tissulaire bioinspiré et le génie génétique, pour former des motifs ECM fonctionnels fusionnés à des protéines de soie recombinantes. Dans des conditions physiologiques adéquates, les protéines de soie bio-ingénierie et la fibronectine-soie (FN-soie) peuvent s'auto-assembler en réseaux de microfibres qui imitent l'ECM native.
Dans une étude récente, Ulrika Johansson, Mona Widhe et ses collègues des départements interdisciplinaires de biotechnologie, Chimie des biomatériaux, et Immunology en Suède ont développé une méthode pour inclure des cellules de mammifères dans une solution de soie avant d'assembler la soie dans des constructions, pour former des microfibres uniformes de type tissu intégré aux cellules. Les constructions d'échafaudage 3-D résultantes ont montré une prolifération cellulaire (croissance) améliorée et une propagation cellulaire homogène par rapport aux cellules encapsulées dans l'hydrogel. Les résultats de l'étude sont maintenant publiés dans Rapports scientifiques .
Les scientifiques ont confirmé l'attachement cellulaire sur des constructions fibronectine-soie (FN-Silk) dans le travail en observant l'actine filamenteuse et en définissant des points d'adhésion focaux de l'attaché, cellules allongées. Ils ont maintenu la viabilité cellulaire pendant 90 jours dans les surfaces cellulaires-FN/soie et ont montré l'évolutivité de la méthode à des cultures cellulaires 3D de taille macro. Les faisceaux de microfibres de soie avec des cellules encapsulées ont maintenu une résistance biomécanique et une extensibilité un peu comme les parois artérielles humaines.
Le protocole développé par Johansson et Widhe et al. a également permis aux cellules souches de se différencier à l'intérieur des constructions 3-D pour aider à la croissance de diverses co-cultures cellulaires. Ils ont montré que les cellules endothéliales pouvaient être incluses dans les matériaux bioinspirés pour former des structures ressemblant à des vaisseaux dans les constructions tissulaires. Les scientifiques envisagent d'utiliser le réseau de type ECM comme base des efforts futurs pour concevoir des tissus biologiques fonctionnels en laboratoire.
La culture in vitro de cellules de mammifères est une technique expérimentale indispensable dans la recherche fondamentale et les applications industrielles, bien que le processus existant repose sur des surfaces en plastique ou en verre dur 2-D pour plus de commodité, ce qui nuit à la réponse biologique native. Étant donné que les cellules biologiques sont naturellement habituées à recevoir des signaux de l'environnement 3-D, les ingénieurs tissulaires ont élaboré de nouvelles stratégies expérimentales en utilisant des cultures cellulaires en 3D. Les conditions expérimentales ont maintenu l'adhésion cellulaire, prolifération et différenciation pour recréer et maintenir le métabolisme et la fonctionnalité cellulaires en laboratoire.
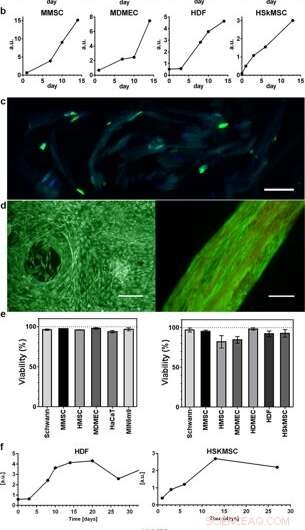
Prolifération et viabilité des cellules intégrées dans la soie 3D. Les graphiques représentatifs du test de viabilité du bleu Alamar montrent une activité métabolique croissante au cours des 2 premières semaines dans (a) la mousse (N = 3–4, n = 3–7), et (b) des fibres (N = 1–9, n = 2–13), reflétant la croissance des différents types cellulaires intégrés (HaCaT; lignée cellulaire de kératinocytes humains, HDF ; fibroblastes dermiques humains, MDMEC ; cellules endothéliales microvasculaires dermiques de souris, MIN6m9 ; lignée de cellules β pancréatiques de souris sécrétant de l'insuline). (c) La division cellulaire se produit profondément dans la soie 3D. Cryosection d'une fibre avec fibroblastes intégrés (HDF) fixée au jour 11 et colorée avec FITC-anti BrdU pour l'ADN nouvellement synthétisé (vert) et DAPI (bleu). La soie présente une faible autofluorescence dans la gamme bleu/vert. (d) Coloration représentative vivante (verte) et morte (rouge) des cellules souches mésenchymateuses de souris (MMSC) en mousse (à gauche) et HDF en fibre (à droite) au jour 14. La fibre montre une faible autofluorescence dans la plage rouge. Barres d'échelle = 100 µm. (e) Viabilité (%, moyenne et écart-type) après 14 jours de culture de différents types cellulaires (voir Suppl. Tableau 1) en mousse (graphique de gauche), et en fibres (graphique de droite) (N = 1–3, n = 4). (f) Des cultures de longue durée de cellules intégrées dans des fibres ont maintenu une activité métabolique (bleu Alamar) pendant toute la période d'étude (jusqu'à 97 jours). Crédit :Rapports scientifiques, doi:10.1038/s41598-019-42541-y
Précédemment, Johansson et Widhe et al. avait développé un processus évolutif pour concevoir la protéine de soie d'araignée recombinante connue sous le nom de 4RepCT pour la culture cellulaire bioinspirée en laboratoire, qui s'auto-assemble en microfibres biodégradables et biocompatibles en milieu aqueux, tampons physiologiques à température ambiante. Ils ont fonctionnalisé la nouvelle construction en utilisant un motif d'adhésion cellulaire de la fibronectine (FN) pour former le matériau FN-soie et favoriser l'attachement cellulaire ferme. Bien que les cellules aient proliféré le long des nouvelles surfaces matérielles, ils sont restés seuls à la surface, incapable de proliférer dans les constructions pour imiter de manière adéquate les propriétés de type tissu in vitro. Dans le travail present, les scientifiques ont donc développé une nouvelle méthode, pour intégrer efficacement les cellules dans le matériau en soie lors de l'assemblage de la soie FN pour une culture cellulaire 3-D encapsulée et viable qui imitait de manière adéquate la matrice extracellulaire in vitro.
Constructions de soie incorporées dans des cellules d'ingénierie tissulaire en laboratoire
Lors des expérimentations, Johansson et Widhe et al., d'abord ajouté une goutte de cellules souches dispersées (cellules souches mésenchymateuses de souris, MMSC) à la solution de protéine FN-soie avant l'assemblage de la solution. Après incubation, le réseau nouvellement formé est resté stable dans les milieux de culture et le nombre de cellules encapsulées a augmenté dans les constructions tout au long de la période de culture. Au bout de trois jours, les alvéoles réparties sur toutes les dimensions de la mousse, que les scientifiques ont observé en utilisant la microscopie à contraste d'interférence différentiel (DIC).
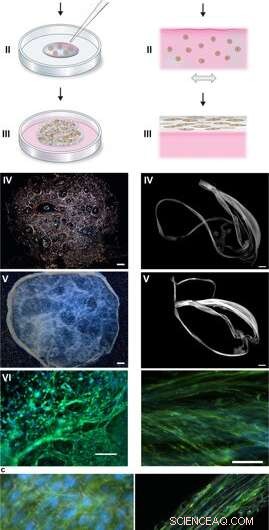
Assemblage de soie pour intégrer des cellules dans un réseau 3D de microfibres. (a) Description schématique de la formation de mousse de soie avec des cellules enracinées. Les cellules en suspension dans le milieu de culture (rose) sont ajoutées à une goutte définie de solution de protéine FN-soie (bleue) placée au milieu d'un puits de culture non traité (I). Les bulles d'air sont rapidement introduites (5-10 sec) à travers une pointe de pipette (II), pour donner naissance à une mousse 3D à alvéoles. Après 30 minutes dans l'incubateur de cellules, du milieu de culture supplémentaire est ajouté pour recouvrir complètement la mousse (III). Jour 1 après formulation, la mousse de soie à alvéoles semble presque transparente, bien qu'abritant quelques bulles d'air restantes (qui disparaissent avec le temps) (IV). Après 2 semaines de culture, la mousse à cellules intégrées présente un aspect plus dense et plus blanc (V). Déjà au jour 3, la mousse est remplie de cellules bien réparties (ici les cellules souches mésenchymateuses de souris (MMSC) sont montrées) (VI). Les filaments d'actine sont visualisés par la phalloïdine (vert) et les noyaux cellulaires par coloration DAPI (bleu). Barre d'échelle IV-V = 1 mm, VI = 100 µm. (b) Description schématique des fibres de soie formées avec des cellules intégrées. Les cellules en suspension dans le milieu (rose) sont ajoutées à la solution de protéine FN-soie (bleu) (I). Au cours d'une légère inclinaison uniaxiale répétée pendant 1 à 3 heures (II), les protéines de soie s'assemblent à l'interface air-liquide en un faisceau macroscopique de microfibres avec des cellules incorporées (III). Les fibres de soie avec les cellules sont facilement récupérées (IV) et peuvent être placées dans un puits pour une culture ultérieure, l'épaisseur augmentant sur 2 semaines (V). Au jour 3, les cellules alignées (ici MMSC) se retrouvent étalées intégrées dans le faisceau de fibres (VI). Les filaments d'actine sont visualisés par la phalloïdine (vert) et les noyaux cellulaires par coloration DAPI (bleu). Barre d'échelle IV-V = 1 mm, VI = 100 µm. (c) Micrographies à contraste d'interférence différentielle (DIC) des microfibres de soie (blanches) dans une fibre (à gauche) et une mousse (à droite) avec des cellules intégrées (MMSC). Les filaments d'actine sont visualisés par la phalloïdine (vert) et les noyaux cellulaires par coloration DAPI (bleu). Barre d'échelle = 50 µm (gauche) et 100 µm (droite). Crédit :Rapports scientifiques, doi:10.1038/s41598-019-42541-y
Ils ont dirigé l'alignement des cellules pour former un réseau 3D aléatoire de microfibres qui ont réussi à imiter les tissus biologiques en formant un faisceau macroscopique de microfibres pendant la chronologie de la culture cellulaire, suivi d'un examen du rapport cellule/ECM. Les scientifiques ont fait varier l'ECM à la composition cellulaire pour imiter ou correspondre à une gamme de types de tissus, y compris les tissus cellulaires clairsemés et à haute densité du foie. La méthode est donc également adaptée à la culture cellulaire en 3D avec des quantités de cellules infimes.
Test de viabilité cellulaire sur les échafaudages en soie – études de cytocompatibilité
Les scientifiques ont utilisé des profils de croissance pour cartographier les divers types de cellules incrustées à la fois dans la mousse et les fibres de l'assemblage de soie. Ils ont observé un signal accru de l'activité métabolique pour représenter la prolifération cellulaire dans les échafaudages de soie 3-D et, avec le temps, ils ont montré une augmentation de la densité cellulaire dans l'échafaudage cellule-soie le plus interne. Johansson et al. étudié la prolifération cellulaire en utilisant la coloration BrdU, où les résultats positifs ont prouvé une prolifération plus profonde et une propagation cellulaire dans les fibres de soie pour maintenir la viabilité cellulaire après 2 semaines d'encapsulation, et pendant des périodes de culture cellulaire à long terme qui s'étendaient sur un à trois mois.
Comparaison de la cytocompatibilité de la soie par rapport aux biomatériaux hydrogel
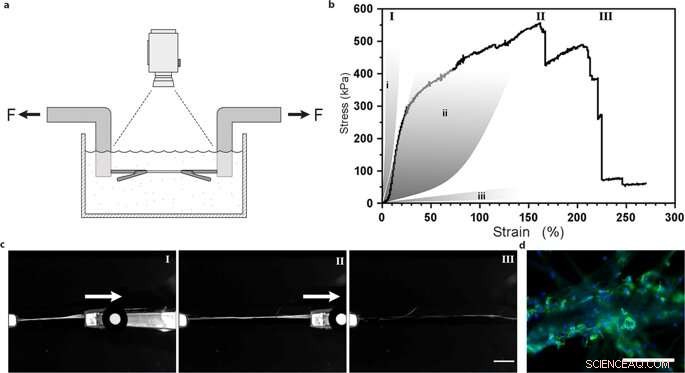
Essai de traction uniaxiale des fibres de soie avec des cellules souches mésenchymateuses intégrées. (a) Illustration du montage expérimental pour les tests de traction réalisés dans du tampon PBS à 37°C afin de maintenir des cellules viables. (b) Représentant First Piola-Kirchhoff contrainte par rapport à la courbe de contrainte d'une fibre de soie FN avec des cellules souches mésenchymateuses intégrées (MMSC) soumises à des tests de traction après 14 jours de culture. La courbe contrainte-déformation illustre une phase plutôt linéaire (et probablement élastique) qui est suivie d'une phase de déformation de type plastique (irréversible) jusqu'à ce que la contrainte maximale soit atteinte, et la fibre se casse. En comparaison, les zones grises représentent des gammes de propriétés de contrainte dans les tendons et les ligaments (i), parois artérielles (ii), et le tissu cérébral (iii). Les chiffres romains renvoient aux images (c) prises lors de l'essai de traction, c'est-à-dire pendant le démarrage (I), l'allongement (II) et la rupture (III) des fibres. Barre d'échelle = 5 mm. (d) Micrographies du point de rupture des fibres avec des MMSC après essai de traction. Les filaments d'actine sont visualisés par coloration à la phalloïdine (vert) et les noyaux cellulaires sont colorés au DAPI (bleu). Barres d'échelle = 200 µm. Crédit :Rapports scientifiques, doi:10.1038/s41598-019-42541-y
Sur la base des résultats préliminaires encourageants, les scientifiques ont mené des expériences parallèles pour comparer la croissance cellulaire dans la soie par rapport à la croissance cellulaire dans l'hydrogel afin de déterminer la cytocompatibilité des deux matériaux. Ils ont choisi l'alginate pour représenter l'hydrogel lors de la culture cellulaire et ont observé des dissemblances entre l'alginate et la soie, enregistrement de l'expansion des cellules claires dans la soie, tandis que les cellules dans l'alginate sont restées dans un état métabolique stable. En utilisant la microscopie confocale, ils ont étudié les raisons de la différence observée dans la croissance cellulaire au niveau du microenvironnement. Les résultats ont montré une fixation rapide des cellules (observée avec des cellules allongées) dans les constructions en soie, tandis que les constructions d'alginate se sont contractées pendant la culture cellulaire, ce qui peut avoir contraint les cellules à se détacher.
Etudes biomécaniques – caractérisation des nouveaux matériaux
Ils ont déterminé que la rigidité de la surface du matériau était un élément crucial qui affectait le devenir des cellules. Pour vérifier cette observation, Johansson et al. testé le comportement biomécanique des constructions en soie pour s'assurer qu'elles imitent adéquatement le tissu natif. Ils ont effectué des essais de traction dans un tampon physiologique pour obtenir les résultats, ce qui a prouvé que les propriétés mécaniques des cellules contenant de la soie correspondaient à celles du tissu conjonctif tel que les parois artérielles. Johansson et al. ont pu démontrer une grande extensibilité des microfibres pour indiquer une transition de force dans et à travers les cellules attachées au nouveau biomatériau, confirmant ainsi l'attachement cellulaire adéquat.
Études de biofonctionnalisation – étude de la biocompatibilité de surface in vitro
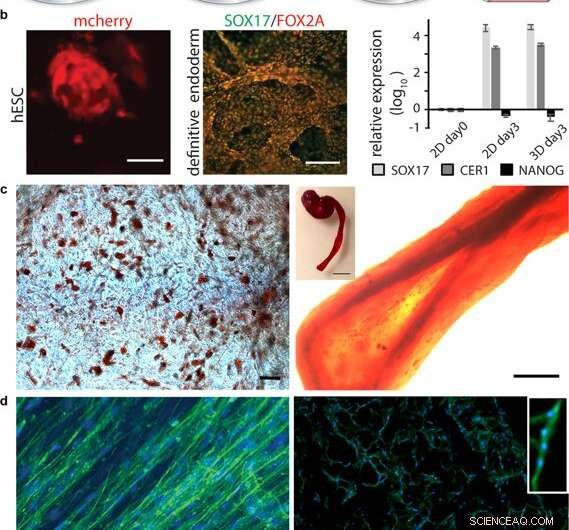
Différenciation des cellules dans la soie 3D. (a) Après expansion initiale des cellules souches intégrées à la soie 3D, la différenciation en divers types de tissus peut être déclenchée par l'ajout de facteurs appropriés. (b) Différenciation des cellules souches pluripotentes. Gauche :Cellules souches embryonnaires humaines (CSEh) visualisées par détection mCherry à 48h après intégration cellulaire dans la mousse FN-soie. Barre d'échelle = 50 µm. Milieu :Immunomarquage des marqueurs endodermiques SOX17 (vert) et FOX2A (rouge) après 3 jours de différenciation. Barres d'échelle = 200 µm. A droite :expression génique (SOX17, CER1, NANOG) de CSEh dans une mousse FN-soie par rapport à une culture 2D, analysés par RT-qPCR au jour 3 de l'induction endodermique. Les barres représentent le facteur de changement moyen ± écart-type (n = 4). (c) Différenciation des cellules souches adultes multipotentes. A gauche :Cellules souches mésenchymateuses humaines (HMSC) dans une mousse de soie FN différenciée en la lignée adipogène contenant des lipides, visualisé par coloration à l'huile rouge (rouge) (N = 2, n = 4). Barre d'échelle = 100 µm. A droite :HMSC différenciées dans la lignée ostéogénique, sondé avec un marqueur ostéogénique pour la teneur en calcium (Alizarin Red S (rouge) dans la fibre de soie FN (à droite, barre d'échelle = 200 µm), (N = 2, n = 4). L'encart montre la photo d'une fibre entière (à droite), barre d'échelle = 1 mm). (d) Différenciation des cellules précurseurs adultes. A gauche :Après 14 jours dans les milieux de différenciation, les cellules satellites du muscle squelettique (HSkMSC) au sein d'une fibre de soie FN présentent des filaments d'actine proéminents, comme visualisé par coloration à la phalloïdine (vert). À droite :différenciation myogénique des cellules satellites du muscle squelettique (HSkMSC) visualisée par coloration à la desmine (vert). Noyaux colorés au DAPI en bleu. (N = 9, n = 4). Barres d'échelle = 200 µm. Un gros plan de la zone d'un myotube multinucléé est montré dans le coin supérieur droit. Crédit :Rapports scientifiques, doi:10.1038/s41598-019-42541-y
Après avoir établi la stabilité biomécanique, les scientifiques ont testé si les cellules souches qui se sont développées sur les échafaudages en soie pouvaient se différencier (mûrir) sur le même matériau. Pour ça, ils ont utilisé des cellules souches embryonnaires humaines pluripotentes et multipotentes dans les tests de culture cellulaire, suivi de la quantification de l'expression génique des marqueurs biologiques de la croissance cellulaire; FOXA2 (gènes métaboliques), SOX17 (gènes pour le développement embryonnaire et la détermination du destin cellulaire), CER1 (antagonistes des protéines morphogénétiques osseuses) et NANOG (prolifération des cellules souches embryonnaires, pluripotence et renouvellement). Dans les résultats, SOX17 et CER1 ont tous deux montré une forte régulation à la hausse, tandis que le biomarqueur de la pluripotence (NANOG) a diminué en raison de la maturité cellulaire en raison de la perte de la pluripotence.
Les scientifiques ont testé la biofonctionnalisation de surface pour divers types de cellules, y compris les cellules satellites du muscle squelettique humain (HSkMSC) et les cellules souches mésenchymateuses humaines dérivées de la moelle osseuse (hMSC). Après expansion cellulaire sur les constructions, les scientifiques pourraient orienter le destin des hMSCs dans des lignées cellulaires adipogènes ou ostéogéniques. En outre, après deux semaines de culture cellulaire, Johansson et al. ont montré une différenciation myogénique des HSkMSC pour former des filaments d'actine proéminents, et exprimer le marqueur spécifique du muscle desmine, pour vérifier la maturation des myotubes in vitro.
Concevoir des vaisseaux biologiques en laboratoire
Les scientifiques ont ensuite combiné des cellules endothéliales dans le réseau vasculaire 3-D pour former un tissu conjonctif qui imitait l'organisation cellulaire inhérente des micro-vaisseaux en laboratoire. Ils ont suivi le même protocole en utilisant un assemblage de soie avec intégration cellulaire et ont ajouté une fraction de cellules endothéliales pour créer le tissu conjonctif. Dans deux semaines, ils ont observé que les cellules se rassemblaient et formaient des pousses ramifiées d'un millimètre de long et des structures ressemblant à des vaisseaux avec des anneaux proéminents de cellules endothéliales dans les fibres de soie. Les scientifiques pourraient augmenter la taille des constructions à l'échelle et déterminer l'alignement et l'agrégation de divers types de cellules.
De cette façon, Johansson et Widhe et al. a démontré une nouvelle stratégie et développé un protocole pour s'adapter aux cellules fonctionnelles dans les réseaux 3-D qui imitaient l'architecture fibreuse de la matrice extracellulaire native (ECM). Pour arbitrer l'expérience, ils ont utilisé des protéines de soie recombinantes auto-assemblantes et ont montré qu'une variété de cellules pouvait être incorporée dans les constructions 3-D. La configuration et le protocole sont simples et économiques, contrairement à l'impression 3D, le processus est frugal et pratique, sans machines coûteuses. Les scientifiques visent à optimiser et standardiser ce protocole pour développer des biocompatibles, matériaux de soie avancés dans l'ingénierie tissulaire. Les travaux expérimentaux auront un large éventail d'applications en science des matériaux en tant que modèles in vitro miniatures pour le développement de médicaments et en tant que constructions tissulaires bio-ingénierie plus larges en médecine régénérative.
© 2019 Réseau Science X