
Des chercheurs de l'Université de Tokyo ont trouvé un moyen d'améliorer la sensibilité de l'imagerie de phase quantitative existante afin que toutes les structures à l'intérieur des cellules vivantes puissent être vues simultanément, des particules minuscules aux grandes structures. Cette représentation artistique de la technique montre des impulsions de lumière sculptée (vert, haut) voyageant à travers une cellule (centre), et sortie (en bas) où les changements dans les ondes lumineuses peuvent être analysés et convertis en une image plus détaillée. Crédit :s-graphics.co.jp, CC BY-NC-ND
Des experts en physique optique ont développé une nouvelle façon de voir à l'intérieur des cellules vivantes plus en détail en utilisant la technologie de microscopie existante et sans avoir besoin d'ajouter des colorants ou des colorants fluorescents.
Étant donné que les cellules individuelles sont presque translucides, les caméras de microscope doivent détecter des différences extrêmement subtiles dans la lumière passant à travers des parties de la cellule. Ces différences sont connues sous le nom de phase de la lumière. Les capteurs d'image de la caméra sont limités par la quantité de différence de phase lumineuse qu'ils peuvent détecter, appelée plage dynamique.
"Pour voir plus de détails en utilisant le même capteur d'image, nous devons étendre la plage dynamique afin que nous puissions détecter de plus petits changements de phase de la lumière, ", a déclaré le professeur agrégé Takuro Ideguchi de l'Institut des sciences et technologies photoniques de l'Université de Tokyo.
L'équipe de recherche a développé une technique pour prendre deux expositions afin de mesurer séparément les grands et les petits changements de phase lumineuse, puis les connecter de manière transparente pour créer une image finale très détaillée. Ils ont nommé leur méthode d'imagerie de phase quantitative par décalage de plage dynamique adaptative (ADRIFT-QPI) et ont récemment publié leurs résultats dans Lumière :science et applications .
"Notre méthode ADRIFT-QPI ne nécessite aucun laser particulier, pas de microscope spécial ni de capteurs d'images ; nous pouvons utiliser des cellules vivantes, nous n'avons pas besoin de taches ou de fluorescence, et il y a très peu de chance de phototoxicité, " dit Ideguchi.
La phototoxicité fait référence au fait de tuer les cellules avec la lumière, qui peut devenir un problème avec d'autres techniques d'imagerie, comme l'imagerie par fluorescence.
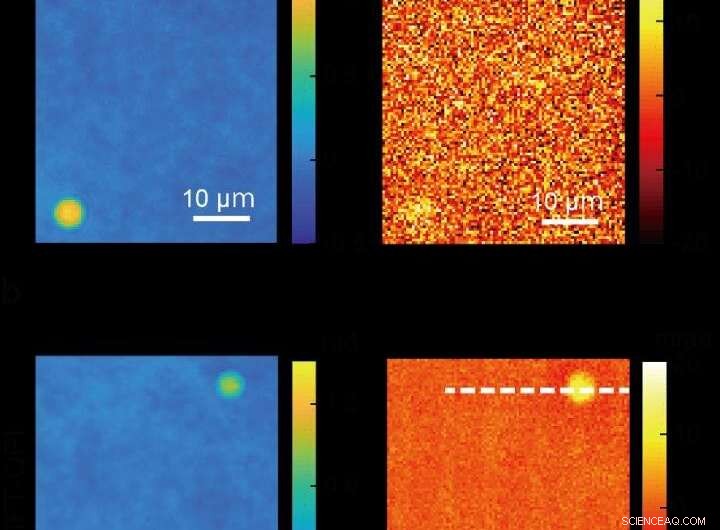
Images de billes de silice prises en utilisant l'imagerie de phase quantitative conventionnelle (en haut) et une image plus claire produite en utilisant une nouvelle méthode de microscopie ADRIFT-QPI (en bas) développée par une équipe de recherche de l'Université de Tokyo. Les photos de gauche sont des images de la phase optique et les images de droite montrent le changement de phase optique dû à l'absorption de lumière dans l'infrarouge moyen (spécifique moléculaire) par les billes de silice. Dans cette démonstration de preuve de concept, les chercheurs ont calculé qu'ils obtenaient une sensibilité environ 7 fois plus élevée avec ADRIFT-QPI que celle avec un QPI conventionnel. Crédit :Toda et al., CC-BY 4.0
L'imagerie de phase quantitative envoie une impulsion d'une feuille plate de lumière vers la cellule, mesure ensuite le déphasage des ondes lumineuses après leur passage dans la cellule. L'analyse informatique reconstitue ensuite une image des principales structures à l'intérieur de la cellule. Ideguchi et ses collaborateurs ont déjà mis au point d'autres méthodes pour améliorer la microscopie de phase quantitative.
L'imagerie de phase quantitative est un outil puissant pour examiner des cellules individuelles car elle permet aux chercheurs de faire des mesures détaillées, comme suivre le taux de croissance d'une cellule en fonction du déplacement des ondes lumineuses. Cependant, l'aspect quantitatif de la technique a une faible sensibilité du fait de la faible capacité de saturation du capteur d'image, ainsi, le suivi de particules nanométriques dans et autour des cellules n'est pas possible avec une approche conventionnelle.
La nouvelle méthode ADRIFT-QPI a surmonté la limitation de la plage dynamique de l'imagerie de phase quantitative. Pendant ADRIFT-QPI, l'appareil photo prend deux expositions et produit une image finale qui a une sensibilité sept fois supérieure à celle des images de microscopie de phase quantitative traditionnelles.
La première exposition est produite avec une imagerie de phase quantitative conventionnelle :une feuille plate de lumière est pulsée vers l'échantillon et les déphasages de la lumière sont mesurés après son passage à travers l'échantillon. Un programme d'analyse d'image informatique développe une image de l'échantillon sur la base de la première exposition, puis conçoit rapidement un front d'onde de lumière sculpté qui reflète cette image de l'échantillon. Un composant séparé appelé dispositif de mise en forme de front d'onde génère ensuite cette "sculpture de lumière" avec une lumière d'intensité plus élevée pour un éclairage plus fort et la projette vers l'échantillon pour une deuxième exposition.
Si la première exposition a produit une image qui était une représentation parfaite de l'échantillon, les ondes lumineuses sculptées sur mesure de la deuxième exposition entreraient dans l'échantillon à différentes phases, passer à travers l'échantillon, puis émerge comme une nappe de lumière plate, la caméra ne voit rien d'autre qu'une image sombre.
« C'est la chose intéressante :nous effaçons en quelque sorte l'image de l'échantillon. Nous ne voulons presque rien voir. Nous annulons les grandes structures pour que nous puissions voir les plus petites dans les moindres détails, " expliqua Ideguchi.
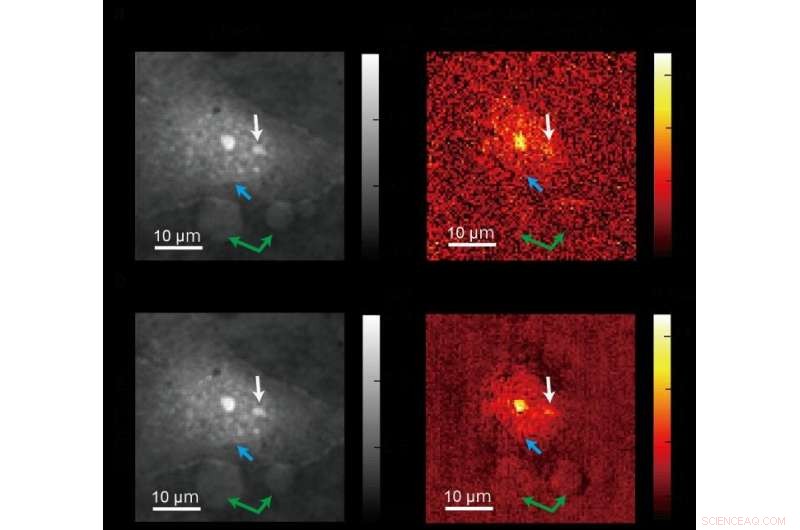
Une image standard (en haut) prise à l'aide d'une imagerie de phase quantitative conventionnelle et une image plus claire (en bas) produite à l'aide d'une nouvelle méthode de microscopie ADRIFT-QPI développée par une équipe de recherche de l'Université de Tokyo. Les photos de gauche sont des images de la phase optique et les images de droite montrent le changement de phase optique dû à l'absorption de la lumière dans l'infrarouge moyen (spécifique moléculaire) principalement par les protéines. La flèche bleue pointe vers le bord du noyau, la flèche blanche pointe vers les nucléoles (une sous-structure à l'intérieur du noyau), et les flèches vertes pointent vers d'autres grosses particules. Crédit :Toda et al., CC-BY 4.0
En réalité, la première exposition est imparfaite, ainsi les ondes lumineuses sculptées émergent avec de subtiles déviations de phase.
La deuxième exposition révèle de minuscules différences de phase de lumière qui ont été « effacées » par des différences plus importantes lors de la première exposition. Ces minuscules différences de phase lumineuse restantes peuvent être mesurées avec une sensibilité accrue en raison de l'éclairage plus puissant utilisé lors de la deuxième exposition.
Une analyse informatique supplémentaire reconstruit une image finale de l'échantillon avec une plage dynamique étendue à partir des deux résultats de mesure. Dans les démonstrations de preuve de concept, les chercheurs estiment que l'ADRIFT-QPI produit des images avec une sensibilité sept fois supérieure à l'imagerie de phase quantitative conventionnelle.
Ideguchi dit que le véritable avantage d'ADRIFT-QPI est sa capacité à voir de minuscules particules dans le contexte de l'ensemble de la cellule vivante sans avoir besoin d'étiquettes ou de taches.
"Par exemple, de petits signaux provenant de particules nanométriques telles que des virus ou des particules se déplaçant à l'intérieur et à l'extérieur d'une cellule pourraient être détectés, qui permet d'observer simultanément leur comportement et l'état de la cellule, " dit Ideguchi.