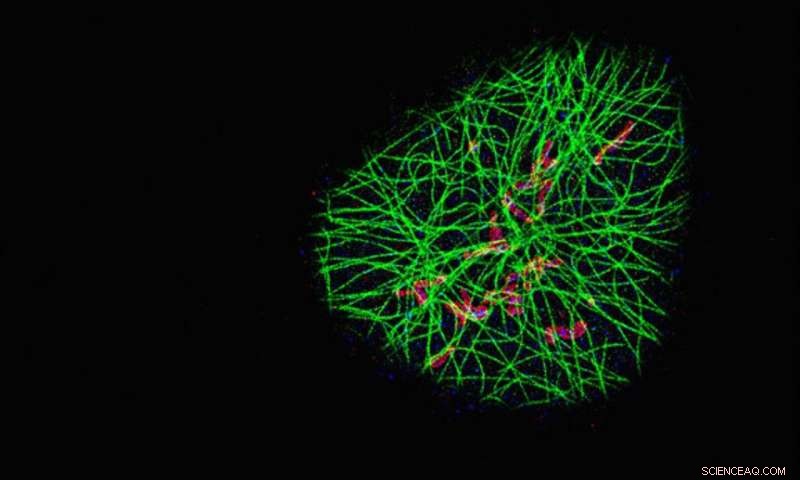
Les chercheurs ont utilisé leur méthode SDC-PAINT pour visualiser le réseau de filaments de microtubules cytosquelettiques (vert) et leur proximité avec deux protéines supplémentaires appelées TOM20 (rouge) et HSP60 (bleu). Chaque image montre les protéines dans un plan différent de la cellule en partant du haut, et les images agrandies en bas comparent la résolution obtenue avec SDC-PAINT (à gauche) à celle possible avec la microscopie confocale conventionnelle (à droite). Crédit :Florian Schueder, MPI/LMU
Les biologistes cellulaires utilisent traditionnellement des colorants fluorescents pour marquer et visualiser les cellules et les molécules qu'elles contiennent au microscope. Avec différentes méthodes de microscopie à super-résolution, ils peuvent même éclairer des molécules isolées et leurs interactions complexes les unes avec les autres. Cependant, le matériel de microscopie qui leur permet de le faire est hautement spécialisé et coûteux et, par conséquent, relativement rare dans les laboratoires du monde entier, et le fonctionnement de tels microscopes est intimidant, car cela nécessite des compétences uniques.
Ralf Jungmann, Doctorat., un ancien élève du Wyss Institute for Biologically Inspired Engineering de Harvard et actuellement professeur à l'Université Ludwig Maximilian (LMU) et à l'Institut Max Planck (MPI) de biochimie en Allemagne et Peng Yin, membre du corps professoral du Wyss Institute, Doctorat., ont développé DNA-PAINT, une puissante technologie d'imagerie moléculaire qui implique des interactions ADN-ADN transitoires pour localiser avec précision les colorants fluorescents avec une super-résolution. Cependant, bien que les chercheurs aient démontré le potentiel de DNA-PAINT en visualisant des biomolécules uniques, comme les protéines, dans des cellules fixes à une distance fixe proche, la technologie ne pouvait pas encore être appliquée pour étudier les molécules profondément à l'intérieur des cellules.
Maintenant, Les équipes de Jungmann et Yin rapportent conjointement une solution pour surmonter cette limitation. Dans leur nouvelle étude, ils ont adapté la technologie DNA-PAINT aux microscopes très répandus dans les laboratoires de biologie cellulaire, appelés microscopes confocaux, et qui sont utilisés par les chercheurs pour imager des cellules entières et des tissus plus épais à une résolution inférieure. L'équipe du MPI/Wyss Institute démontre que la méthode peut visualiser une variété de molécules différentes, y compris des combinaisons de différentes protéines, ARN et ADN sur toute la profondeur de cellules entières à super-résolution. Publié dans Communication Nature , l'approche pourrait ouvrir la porte à des études détaillées de localisation de molécules uniques dans de nombreux domaines de la recherche cellulaire.
L'approche DNA-PAINT attache un "brin d'ancrage" d'ADN à la molécule d'intérêt. Ensuite, un "brin imageur" d'ADN marqué par un colorant avec une séquence complémentaire se fixe de manière transitoire à l'ancre et produit un signal fluorescent, qui se produit comme un événement clignotant défini sur des sites moléculaires uniques. Parce que "clignoter" est précisément réglable, les molécules qui ne sont distantes que de quelques nanomètres les unes des autres peuvent être distinguées, à l'extrémité de résolution la plus élevée de la super-résolution.
"Notre nouvelle approche, SDC-PEINTURE, intègre les capacités polyvalentes de super-résolution de DNA-PAINT avec les fonctionnalités de sectionnement optique des microscopes confocaux. Nous avons ainsi créé le moyen d'explorer toute la profondeur d'une cellule, et de visualiser les molécules qu'il contient à l'échelle nanométrique, " a déclaré Jungmann. L'équipe a cartographié la présence de différentes combinaisons de protéines dans des cellules entières et est ensuite allée au-delà. " En diversifiant nos approches de marquage, nous avons également visualisé différents types de biomolécules individuelles dans le noyau contenant le chromosome, y compris les séquences dans l'ADN, des protéines liées à l'ADN ou à la membrane qui enferme le noyau, ainsi que les ARN nucléaires, " ajoute Yin, qui est également co-responsable de la Molecular Robotics Initiative du Wyss Institute, et professeur de biologie des systèmes à la Harvard Medical School. .
En principe, Les microscopes confocaux utilisent ce que l'on appelle des trous d'épingle pour éliminer la fluorescence non focalisée indésirable des plans d'image au-dessus et au-dessous du plan focal. En parcourant l'échantillon, avion après avion, les chercheurs peuvent recueillir les signaux de fluorescence émis par les colorants liés aux molécules sur toute la profondeur. Spécifiquement, l'équipe du MPI/Wyss Institute a développé la technique des microscopes "Spinning Disk Confocal" (SDC) qui détectent les signaux de fluorescence d'un plan entier à la fois en les détectant à travers un disque rotatif doté de plusieurs trous d'épingle. De plus, "pour obtenir une super-résolution 3D, nous avons placé une lentille supplémentaire dans le chemin de détection, ce qui nous permet d'archiver une résolution limitée à la sous-diffraction dans la troisième dimension", a déclaré le premier auteur Florian Schueder, un étudiant diplômé travaillant avec Jungmann qui a également travaillé avec l'équipe du Yin's Wyss Institute dans le cadre de sa thèse de maîtrise.
« Cet ajout peut être facilement personnalisé par les fabricants de microscopes SDC ; nous mettons donc essentiellement en œuvre la microscopie à super-résolution sans modifications matérielles complexes des microscopes qui sont généralement disponibles pour les biologistes cellulaires de tous les domaines de la recherche biomédicale. L'approche a donc le potentiel de démocratiser la super -imagerie de résolution à travers des cellules entières et des tissus, " a déclaré Jungmann.
"Avec cette avancée importante, la microscopie super-résolution et DNA-PAINT pourraient devenir plus accessibles aux chercheurs biomédicaux, accélérer nos connaissances sur la fonction des molécules individuelles et les processus qu'elles contrôlent au sein des cellules, " a déclaré le directeur fondateur du Wyss Institute, Donald Ingber, MARYLAND., Doctorat., qui est également le professeur Judah Folkman de biologie vasculaire au HMS et le programme de biologie vasculaire du Boston Children's Hospital, ainsi que professeur de bio-ingénierie à SEAS.