Les bouches hydrothermales du bassin de Guaymas - la "maison" des micro-organismes oxydants du méthane étudiés. Les micro-organismes aimant la chaleur se développent sous le tapis microbien orange en arrière-plan. Les températures élevées de la montée des eaux brouillent certaines parties de l'image. Crédit : Institut océanographique de Woods Hole
Méthane, un composé chimique de formule moléculaire CH
Ce processus se déroule globalement dans le fond marin et constitue donc une partie importante du cycle du carbone. Cependant, étudier le processus AOM est difficile car la réaction est très lente. Pour son enquête, les chercheurs utilisent souvent un truc chimique :les rapports d'isotopes stables dans le méthane. Mais malheureusement, ces isotopes ne se comportent pas toujours comme prévu, ce qui a conduit à une sérieuse confusion sur le rôle et la fonction des microbes impliqués. Des chercheurs du Max Planck Institute for Marine Microbiology et du MARUM—Center for Marine Environmental Sciences en Allemagne ainsi que des collègues du Weizmann Institute of Science en Israël ont résolu cette énigme isotopique et publié leurs résultats dans la revue Avancées scientifiques . Cela ouvre la voie à une meilleure compréhension du processus important d'oxydation anaérobie du méthane.
Les isotopes révèlent les voies de réaction
Le puzzle et sa solution en détail :Les isotopes sont différentes "versions" d'un élément avec des masses différentes. Les isotopes d'un élément ont le même nombre de protons (particules chargées positivement) dans le noyau et donc la même position dans le tableau périodique (iso topos =grec, même endroit). Cependant, ils diffèrent par le nombre de neutrons (particules neutres) dans le noyau. Par exemple, le carbone a deux isotopes stables, le briquet
12
C et le plus lourd
13
C. De plus, il y a l'isotope radioactif familier
14
C, une espèce de carbone très rare qui est utilisée pour déterminer l'âge des matériaux carbonés. Bien que les propriétés chimiques des deux isotopes stables soient identiques, la différence de masse entraîne des vitesses de réaction différentes. Lorsque des composés chimiques réagissent, ceux avec les isotopes les plus légers sont généralement convertis plus rapidement, laissant la variante la plus lourde dans le réactif initial. Ce changement de composition isotopique est connu sous le nom de fractionnement isotopique, et a été utilisé pendant des décennies pour suivre les réactions chimiques. Dans le cas de l'oxydation du méthane, cela signifie que
12
Le C-méthane est principalement consommé, conduisant à un enrichissement en 13C du méthane restant. Inversement, une production microbienne de méthane (méthanogénèse) conduirait à un méthane particulièrement léger. "Réalité, cependant, est étonnamment différent, » rapporte Gunter Wegener. « Contrairement à la logique décrite ci-dessus, on trouve souvent du méthane très léger dans les zones de transition sulfate-méthane."
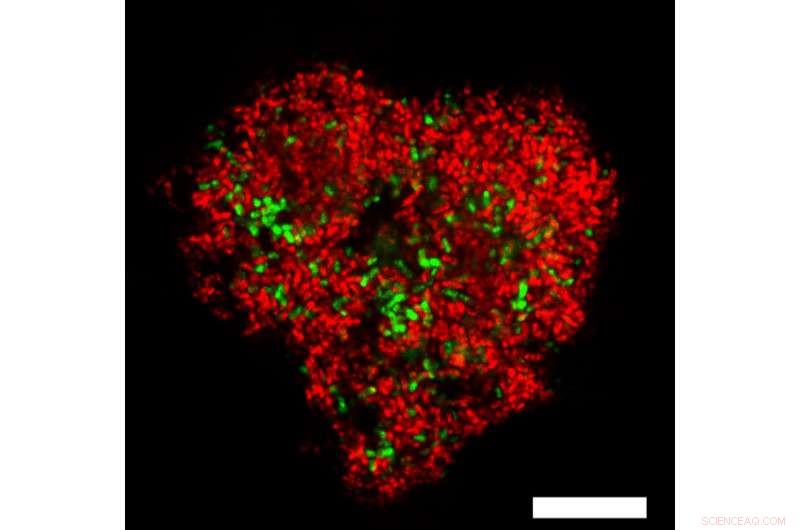
Consortiums microbiens d'archées anaérobies oxydant le méthane colorées en rouge et leurs bactéries partenaires réductrices de sulfate colorées en vert. La barre d'échelle blanche marque 10 um. Crédit :Institut Max Planck de microbiologie marine / V. Krukenberg
La nature ne suit pas le manuel :le méthane léger dans les zones de transition sulfate-méthane
Ce paradoxe soulève des questions, tels que :le méthane n'y est-il pas consommé, mais plutôt produit ? Et qui, sinon les nombreuses archées ANME, devrait être responsable de cela? « Dans mon laboratoire, nous avons la plus grande collection au monde de cultures ANME. Là, nous pourrions essayer de savoir si et comment les oxydants du méthane eux-mêmes pourraient être responsables de la formation de méthane léger, » poursuit Wegener. « Les premiers résultats ont été dégonflants :aux fortes concentrations de sulfate que l'on trouve normalement dans l'eau de mer, les micro-organismes cultivés se sont comportés conformément au manuel. Le méthane restant a été enrichi en isotopes plus lourds. » Cependant, si les mêmes expériences étaient réalisées avec peu de sulfate, le méthane s'est enrichi en 12C, il est devenu plus léger. Et cela s'est produit même si le méthane a continué à être consommé en même temps, un effet qui à première vue avait peu de logique.
La disponibilité du sulfate régit les effets des isotopes dans l'OMA
Alors, comment pourraient-ils expliquer le comportement inhabituel des isotopes du méthane ? Jonathan Gropp et son mentor Itay Halevy du Weizmann Institute of Science en Israël ont passé des années à étudier les effets isotopiques des métabolismes microbiens, y compris la méthanogenèse, une réaction catalysée par les mêmes enzymes que l'oxydation anaérobie du méthane (AOM). Ainsi, ils étaient les partenaires idéaux de l'équipe basée à Brême. "Les deux processus sont basés sur une cascade très similaire de sept réactions, " dit Gropp. " Des études antérieures ont montré que toutes ces réactions sont potentiellement réversibles, ce qui signifie qu'ils peuvent avoir lieu dans les deux sens. Chaque réaction a aussi ses propres effets isotopiques." A l'aide d'un modèle, Gropp a pu montrer que, selon la quantité de sulfate disponible, les réactions partielles peuvent être inversées à des degrés divers. Cela pourrait alors conduire à la situation selon laquelle les isotopes lourds ne sont pas comme d'habitude laissés pour compte mais sont bloqués dans la chaîne de réaction, tandis que les isotopes légers sont renvoyés vers le méthane. "Les microbes veulent effectuer la réaction mais sont limités à le faire en raison des faibles concentrations de sulfate, " explique Gropp, ajoutant que "Notre modèle conçu s'adapte très bien aux expériences sur les isotopes."
Les longues heures en laboratoire et devant l'ordinateur ont payé pour les chercheurs. Avec leur étude, Wegener, Gropp et leurs collègues pourraient montrer comment l'AOM entraîne
13
Méthane appauvri en C. Les expériences avec peu de sulfate en particulier reflètent bien les conditions dans l'habitat naturel des micro-organismes, les zones de transition sulfate-méthane dans le fond marin. Là, les micro-organismes se développent souvent avec peu de sulfate, comme dans les expériences à faible teneur en sulfate. "Maintenant, nous savons que les oxydants du méthane peuvent être responsables de l'accumulation d'isotopes légers dans le méthane dans les zones de transition sulfate-méthane. La méthanogénèse n'est pas nécessaire pour cela. Comme nous le soupçonnions, les ANME sont des oxydants de méthane, " conclut Marcus Elvert, dernier auteur de la présente étude. Maintenant, les chercheurs sont prêts pour la prochaine étape et veulent savoir si d'autres réactions présentent des effets isotopiques similaires.