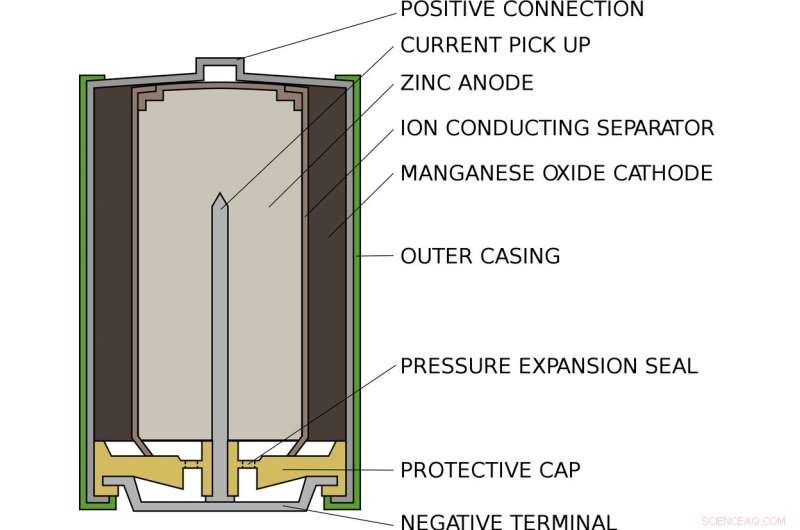
À quoi ressemble une pile alcaline AA standard à l'intérieur. Crédit :Titulaire principal/Wikimedia Commons
L'ère des smartphones n'a qu'un peu plus d'une décennie, mais les ordinateurs de poche au cœur de cette transformation sociétale ne sont vraiment possibles que grâce à une autre technologie :les batteries lithium-ion.
Commercialisé pour la première fois en 1991 par Sony pour ses caméscopes, ces types de batteries sont bons pour bien plus que les appareils électroniques portables grand public. Ils sont au centre de deux autres révolutions technologiques ayant le pouvoir de transformer la société :le passage des moteurs thermiques aux véhicules électriques, et le passage d'un réseau électrique alimenté par des combustibles fossiles à des générateurs d'énergie renouvelable qui stockent le surplus d'électricité dans des batteries pour une utilisation future.
Alors comment fonctionnent ces batteries ? Les scientifiques et les ingénieurs ont passé des carrières entières à essayer de construire de meilleures batteries et il y a encore des mystères que nous ne comprenons pas complètement. L'amélioration des batteries oblige les chimistes et les physiciens à examiner les changements au niveau atomique, ainsi que des ingénieurs en mécanique et en électricité qui peuvent concevoir et assembler les blocs-batteries qui alimentent les appareils. En tant que scientifique des matériaux à l'Université de Washington et au Pacific Northwest National Lab, mon travail a permis d'explorer de nouveaux matériaux pour les batteries lithium-air, des batteries au magnésium et bien sûr des batteries lithium-ion.
Considérons un jour dans la vie de deux électrons. Nous nommerons l'un d'eux Alex et il a un ami nommé George.
Anatomie de la batterie
Alex vit dans une pile alcaline AA standard, comme dans votre lampe de poche ou votre télécommande. À l'intérieur d'une pile AA, il y a un compartiment rempli de zinc et un autre rempli d'oxyde de manganèse. D'un bout, le zinc ne s'accroche que faiblement aux électrons comme Alex. De l'autre côté, l'oxyde de manganèse attire puissamment les électrons vers lui. Entre, empêcher les électrons d'aller directement d'un côté à l'autre, est un morceau de papier trempé dans une solution de potassium et d'eau, qui coexistent sous forme d'ions potassium positifs et d'ions hydroxyde négatifs.
Lorsque la batterie est insérée dans un appareil et allumée, le circuit interne de l'appareil est terminé. Alex se fait sortir du zinc, à travers le circuit et dans l'oxyde de manganèse. Le long du chemin, son mouvement alimente l'appareil, ou une ampoule ou tout ce qui est connecté à la batterie. Quand Alex s'en va, il ne peut pas revenir :le zinc qui a perdu un électron se lie à l'hydroxyde pour former de l'oxyde de zinc. Ce composé est extrêmement stable et ne peut pas être facilement reconverti en zinc.
De l'autre côté de la batterie, l'oxyde de manganèse tire un atome d'oxygène de l'eau et laisse derrière lui des ions hydroxyde pour équilibrer l'hydroxyde consommé par le zinc. Une fois que tous les voisins d'Alex ont quitté le zinc et sont passés à l'oxyde de manganèse, la batterie est épuisée et doit être recyclée.
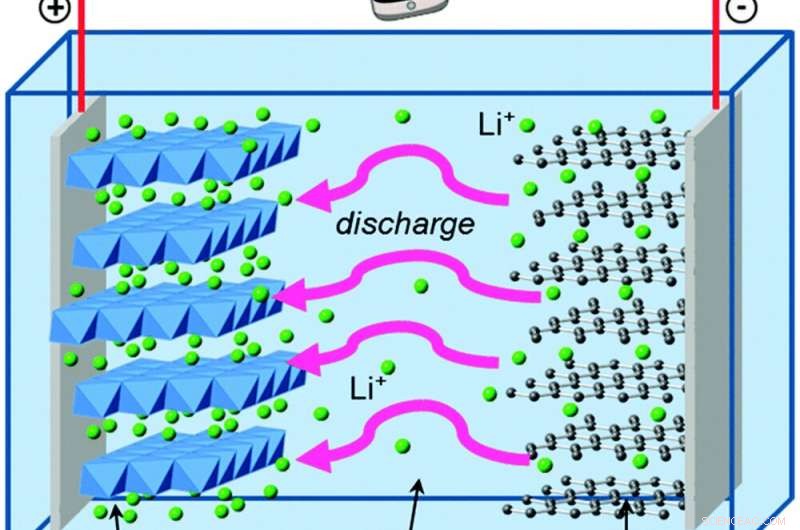
Lorsque les électrons se déplacent à l'extérieur de la batterie, les ions lithium se déplacent à l'intérieur pour maintenir l'équilibre électrique. Crédit :Islam et Fisher, Avis de la société chimique, 2014., CC PAR
Avantages du lithium-ion
Comparons cela à George, qui vit dans une batterie lithium-ion. Les batteries lithium-ion ont les mêmes éléments de base que les piles alcalines AA, avec quelques différences qui confèrent des avantages majeurs.
George vit dans le graphite, qui est encore plus faible que le zinc pour retenir les électrons. Et l'autre partie de sa batterie est de l'oxyde de cobalt et de lithium, qui attire les électrons beaucoup plus puissamment que l'oxyde de manganèse, ce qui donne à sa batterie la capacité de stocker beaucoup plus d'énergie dans le même espace qu'une pile alcaline. La solution séparant le graphite et l'oxyde de cobalt-lithium contient des ions lithium chargés positivement, qui forment et brisent facilement des liaisons chimiques lorsque la batterie est déchargée et rechargée.
Ces réactions chimiques sont réversibles, contrairement à la formation d'oxyde de zinc, c'est ce qui permet aux électrons et aux ions lithium de circuler dans les deux sens sur de nombreux cycles de charge et de décharge.
Ce processus n'est pas efficace à 100 %, cependant, toutes les batteries finissent par perdre leur capacité à retenir l'énergie. Néanmoins, la famille des produits chimiques Li-ion a été suffisamment puissante pour dominer la technologie des batteries aujourd'hui.
Cet article est republié à partir de The Conversation sous une licence Creative Commons. Lire l'article original. 