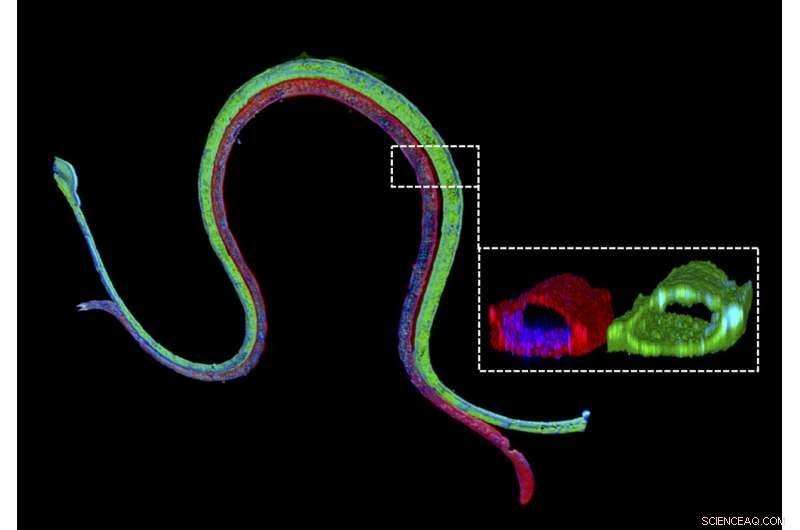
Coloration par immunofluorescence d'un tubule proximal vascularisé bio-imprimé en 3D avec un marqueur épithélial du tubule proximal coloré en vert dans le canal du tubule proximal et un marqueur endothélial vasculaire coloré en rouge dans le canal vasculaire adjacent. La coupe transversale agrandie illustre que les deux types de cellules différents forment des structures perfusables luminales dans leurs canaux respectifs. Crédit :Institut Wyss de l'Université Harvard
Chaque jour, nos reins s'attaquent à la tâche ardue de nettoyer continuellement notre sang pour éviter le gaspillage, le sel et l'excès de liquide s'accumulent à l'intérieur de notre corps. Pour y parvenir, les reins environ un million d'unités de filtration (glomérules) éliminent d'abord les déchets et les précieux nutriments de la circulation sanguine, puis des structures spécialisées connues sous le nom de tubules proximaux réabsorbent les « bonnes » molécules qui les renvoient dans notre circulation sanguine. Alors que les fonctions de réabsorption du tubule proximal peuvent être compromises par des médicaments, produits chimiques, ou des maladies génétiques et transmises par le sang, notre compréhension de la façon dont ces effets se produisent est encore limitée.
Pour permettre l'étude de la réabsorption rénale en dehors du corps humain, Jennifer Lewis, membre du corps professoral du Wyss Institute, Sc.D., et son équipe travaillant au sein de l'Initiative d'ingénierie des organes en 3D du Wyss Institute qu'elle co-dirige, et en collaboration avec le Roche Innovation Center Basel en Suisse, a créé un modèle de tubule proximal vascularisé en 3D dans lequel des tubules et des vaisseaux sanguins perfusables indépendamment sont imprimés les uns à côté des autres dans une matrice extracellulaire conçue. Ce travail s'appuie sur un modèle de tubule proximal 3-D perfusé en continu rapporté plus tôt par l'équipe qui manquait encore d'un compartiment de vaisseau sanguin fonctionnel. Grâce à leur appareil de nouvelle génération, l'équipe a mesuré le transport du glucose du tubule proximal vers les vaisseaux sanguins, ainsi que les effets de l'hyperglycémie, une condition associée au diabète chez les patients. Leur étude est publiée dans le Actes de l'Académie nationale des sciences ( PNAS ).
Lewis est également le professeur Hansjörg Wyss d'ingénierie biologiquement inspiré à la Harvard John A. Paulson School of Engineering and Applied Science (SEAS), le professeur Jianmin Yu des arts et des sciences et membre du Harvard Stem Cell Institute.
"Nous construisons ces appareils rénaux vivants en quelques jours et ils peuvent rester stables et fonctionnels pendant des mois, " a déclaré le premier auteur Neil Lin, Doctorat., qui est Roche Fellow et Postdoctoral Fellow dans l'équipe de Lewis. " Surtout, ces tubules proximaux vascularisés 3-D présentent les morphologies cellulaires épithéliales et endothéliales et les architectures luminales souhaitées, ainsi que l'expression et la localisation correcte de protéines de structure et de transport clés, et des facteurs qui permettent aux compartiments tubulaire et vasculaire de communiquer entre eux.
Dans un premier temps vers le test de médicaments et la modélisation des maladies, l'équipe a induit une "hyperglycémie", un taux de glucose élevé typique du diabète et un facteur de risque connu de maladie vasculaire, dans leur modèle en faisant circuler une concentration de glucose quatre fois supérieure à la normale à travers le compartiment du tubule proximal. "Nous avons découvert que des niveaux élevés de glucose transportés vers les cellules endothéliales du compartiment vasculaire causaient des dommages cellulaires, " a déclaré Kimberly Homan, Doctorat., un co-auteur de l'étude et associé de recherche dans le groupe de Lewis à l'Institut Wyss et SEAS. "En faisant circuler un médicament à travers le tubule qui inhibe spécifiquement un transporteur de glucose majeur dans les cellules épithéliales du tubule proximaux, nous avons empêché ces changements nocifs de se produire dans les cellules endothéliales des vaisseaux adjacents."
L'objectif immédiat de l'équipe est de développer davantage ces modèles pour une utilisation dans des applications pharmaceutiques. « Notre système pourrait permettre le criblage de bibliothèques de médicaments ciblées pour la toxicité rénale et ainsi aider à réduire les expérimentations animales, " dit Annie Moisan, Doctorat., un co-auteur et collaborateur industriel de l'étude, et scientifique principal au Roche Innovation Center Basel. "Je suis ravi des efforts continus de nous et d'autres pour augmenter la pertinence physiologique de ces modèles, par exemple en incorporant des cellules spécifiques du patient et malades, puisque l'efficacité et l'innocuité personnalisées sont les objectifs ultimes de la prédiction des réponses cliniques aux médicaments. »
"Notre nouveau modèle de rein 3-D est une avancée passionnante car il récapitule plus complètement les segments de tubule proximaux trouvés dans le tissu rénal natif, " a déclaré Lewis. " Au-delà de ses applications immédiates pour le dépistage des médicaments et la modélisation des maladies, nous cherchons également à savoir si ces dispositifs vivants peuvent être utilisés pour augmenter la dialyse rénale. » Actuellement, les appareils de dialyse qui sauvent des vies filtrent le sang, mais ils sont incapables de récupérer les précieux nutriments et autres espèces du filtrat dont le corps a besoin pour bon nombre de ses fonctions, ce qui peut entraîner des déficiences et des complications spécifiques sur toute la ligne. Lewis et ses collègues pensent que les tubules vascularisés bio-imprimés en 3D peuvent conduire à de meilleures thérapies de remplacement rénal.
"This study presents a significant step forward in human kidney engineering that enables human disease and drug-related studies to be carried out over extended periods of time in vitro. It also represents a major step forward for the Wyss Institute's 3-D Organ Engineering Initiative, which aims to generate functional organ replacements with enhanced functionalities for patients in need, " said Wyss Institute Founding Director Donald Ingber, MARYLAND., Doctorat., who is also the Judah Folkman Professor of Vascular Biology at HMS and the Vascular Biology Program at Boston Children's Hospital, as well as Professor of Bioengineering at SEAS.