Dans une étude publiée dans Proceedings of the National Academy of Sciences , les chercheurs d'Umeå décrivent une molécule semblable à un produit naturel, la tantalosine, qui inhibe l'interaction entre deux protéines dans des complexes qui remodèlent les membranes à l'intérieur de la cellule.
Les résultats conduisent à une compréhension plus approfondie du fonctionnement du remodelage membranaire dans les cellules humaines et au développement futur de nouveaux médicaments.
"Notre étude constitue un bon exemple d'utilisation de petites molécules comme outils chimiques précieux pour comprendre des mécanismes biologiques complexes. Je suis heureux de coordonner une collaboration fantastique avec des collègues d'Umeå, de Stockholm et d'Allemagne", déclare Yaowen Wu, professeur au Département de chimie de Université d'Umeå.
Les membranes des cellules sont constituées de lipides et de protéines et remplissent des fonctions de barrière pour les cellules et les organites intracellulaires. Les membranes cellulaires sont des structures fluides en mosaïque hautement dynamiques qui subissent un remodelage constant. Le complexe de tri endosomal nécessaire au transport (ESCRT) est chargé de remodeler les membranes à l’intérieur de la cellule. La machinerie ESCRT s'assemble sur le site de la cellule où les membranes doivent être déformées, puis forme des polymères protéiques hélicoïdaux qui peuvent se contracter et pincer les membranes cellulaires.
Auparavant, le professeur Yaowen Wu et son groupe, en collaboration avec le laboratoire du professeur Herbert Waldmann à l'Institut Max Planck de Dortmund en Allemagne, ont identifié une molécule chimique, la tantalosine, qui induit un phénotype comme l'autophagie, un processus d'auto-alimentation dans la cellule.
La tantalosine est une molécule synthétique inspirée des alcaloïdes de la plante médicale quinquina. L’équipe a observé un phénomène très intéressant dans la cellule traitée avec la tantalosine et a étudié plus en détail le mécanisme moléculaire par lequel la tantalosine agit dans la cellule. En collaboration avec le centre de protéomique chimique du SciLifeLab de l'Institut Karolinska, l'équipe a examiné les cibles cellulaires potentielles de la tantalosine.
"À notre grande surprise, nous avons constaté qu'aucune des protéines liées à l'autophagie ne figurait sur la liste des cibles potentielles. Cependant, la protéine IST1 dans les complexes ESCRT a été identifiée et validée comme cible cellulaire de la tantalosine. Nous étions ravis de travailler à déchiffrer cette découverte inattendue. lien entre les complexes ESCRT et l'autophagie", explique la première auteure Anastasia Knyazeva, qui vient tout juste de terminer son doctorat au Département de chimie de l'Université d'Umeå.
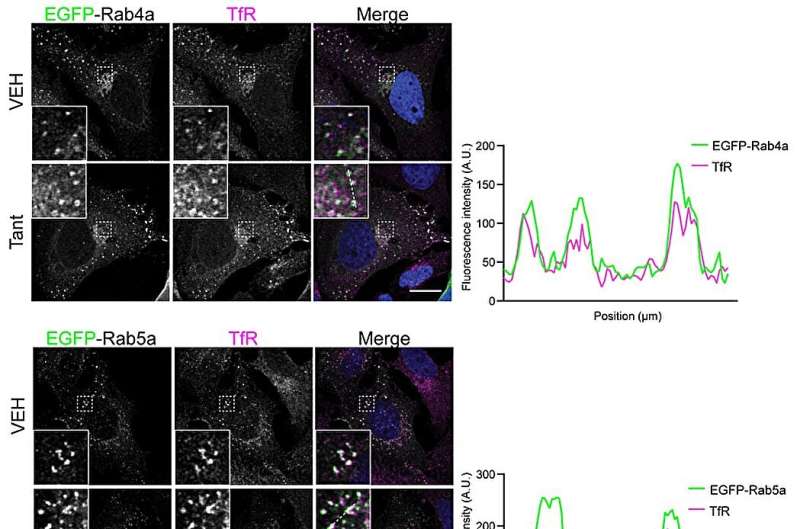
Les chercheurs ont caractérisé le mécanisme à l’aide d’une gamme de méthodes biochimiques et biologiques cellulaires. Lorsqu'ils ont étudié l'interaction protéine-protéine en solution, ils ont découvert que la tantalosine arrête complètement l'interaction entre IST1 et son partenaire de liaison CHMP1B.
"Nous avons ensuite examiné ces deux protéines de plus près à l'aide d'un microscope électronique à transmission en collaboration avec Kasturika Shankar, doctorante du laboratoire de Lars-Anders Carlson à l'Université d'Umeå. Curieusement, la tantalosine perturbe la formation de filaments ordonnés IST1-CHMP1B. ", explique Shuang Li, co-premier auteur de l'article et chercheur postdoctoral au Département de chimie de l'Université d'Umeå.
En outre, les chercheurs ont examiné l’intérieur de la cellule et ont découvert que la tantalosine perturbe rapidement le recyclage des récepteurs de la surface cellulaire vers la surface cellulaire. Cette propriété pourrait être potentiellement bénéfique pour le traitement de certains types de cancers provoqués par les récepteurs de la surface cellulaire.
Dans cette étude, les chercheurs ont découvert que la protéine LC3, qui est généralement une caractéristique de l’autophagie, est liée aux membranes endosomales pendant le traitement à la tantalosine. Fait intéressant, la dégradation autophagique canonique n’a pas été observée. Au lieu de cela, ils ont découvert que le processus suit une voie d'autophagie non canonique.
"Nous pensons que la tantalosine peut être une molécule unique qui facilite la compréhension de nouvelles fonctions de conjugaison non canonique de LC3 aux membranes endosomales. Nous espérons que d'autres études révéleront le rôle de la conjugaison LC3-membrane et de ses protéines associées dans les processus de déformation membranaire", explique Knyazeva. .
Plus d'informations : Anastasia Knyazeva et al, Un inhibiteur chimique de l'interaction IST1-CHMP1B altère le recyclage endosomal et induit une lipidation non canonique de la LC3, Actes de l'Académie nationale des sciences (2024). DOI : 10.1073/pnas.2317680121
Informations sur le journal : Actes de l'Académie nationale des sciences
Fourni par l'Université d'Umea