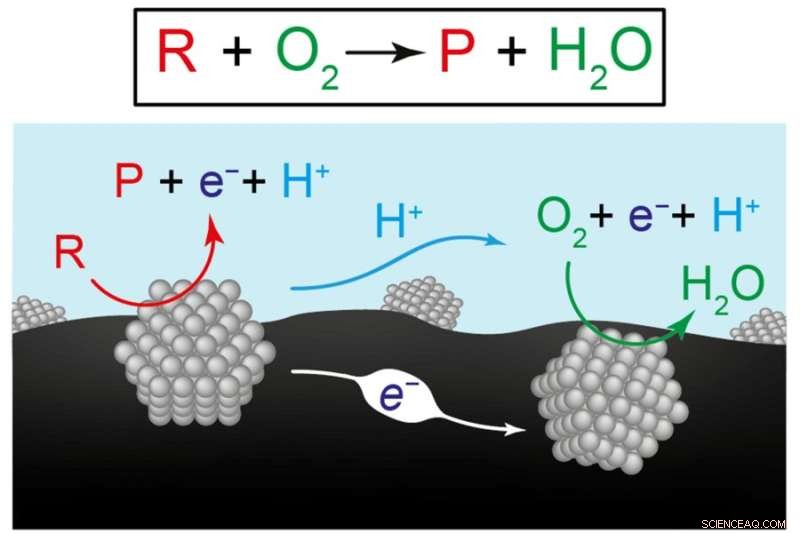
Cette figure présente deux vues des réactions chimiques pour produire des carburants et des produits chimiques renouvelables. L'équation du haut représente la conversion du réactif (R) plus oxygène (O2) en un produit (P) plus eau (H2O). Le diagramme ci-dessous illustre l'hypothèse des chercheurs selon laquelle la réaction globale est le résultat de deux demi-réactions coordonnées se produisant sur des matériaux catalyseurs distincts, représentés ici par des structures grises. Sur le catalyseur de gauche, le réactif se transforme en produit, envoyant des électrons (e-) dans le matériau de support en carbone (noir) et des protons (H+) dans l'eau (bleu). Sur le catalyseur de droite, les électrons et les protons sont consommés car ils entraînent la réaction de l'oxygène à l'eau. Crédit :image reproduite avec l'aimable autorisation des chercheurs.
L'un des défis de la décarbonisation du système énergétique est de savoir comment gérer les nouveaux types de carburants. Les combustibles traditionnels tels que le gaz naturel et le pétrole peuvent être combinés avec d'autres matériaux, puis chauffés à des températures élevées afin qu'ils réagissent chimiquement pour produire d'autres combustibles ou substances utiles, voire de l'énergie pour effectuer un travail. Mais les nouveaux matériaux tels que les biocarburants ne peuvent pas absorber autant de chaleur sans se décomposer.
Un ingrédient clé dans de telles réactions chimiques est un catalyseur solide spécialement conçu qui est ajouté pour favoriser la réaction, mais qui n'est pas lui-même consommé dans le processus. Avec les matériaux traditionnels, le catalyseur solide interagit généralement avec un gaz; mais avec des carburants dérivés de la biomasse, par exemple, le catalyseur doit fonctionner avec un liquide, un défi particulier pour ceux qui conçoivent des catalyseurs.
Pendant près d'une décennie, Yogesh Surendranath, professeur agrégé de chimie au MIT, s'est concentré sur les réactions chimiques entre les catalyseurs solides et les liquides, mais dans une situation différente :plutôt que d'utiliser la chaleur pour provoquer des réactions, lui et son équipe injectent de l'électricité à partir d'un batterie ou une source renouvelable telle que le vent ou le soleil pour donner plus d'énergie aux molécules chimiquement inactives afin qu'elles réagissent. Et la clé de leurs recherches est la conception et la fabrication de catalyseurs solides qui fonctionnent bien pour les réactions impliquant des liquides.
Reconnaissant la nécessité d'utiliser la biomasse pour développer des carburants liquides durables, Surendranath s'est demandé si lui et son équipe pourraient prendre les principes qu'ils ont appris sur la conception de catalyseurs pour conduire des réactions liquide-solide avec de l'électricité et les appliquer aux réactions qui se produisent aux interfaces liquide-solide sans tout apport d'électricité.
À leur grande surprise, ils ont constaté que leurs connaissances étaient directement pertinentes. Pourquoi? "Ce que nous avons découvert, c'est incroyable, c'est que même lorsque vous ne connectez pas de fils à votre catalyseur, il y a de minuscules" fils "internes qui font la réaction", déclare Surendranath. "Ainsi, les réactions que les gens pensent généralement fonctionner sans aucun flux de courant impliquent en réalité des électrons faisant la navette d'un endroit à un autre." Et cela signifie que Surendranath et son équipe peuvent utiliser les puissantes techniques de l'électrochimie pour résoudre le problème de la conception de catalyseurs pour des carburants durables.
Une nouvelle hypothèse
Leurs travaux se sont concentrés sur une classe de réactions chimiques importantes dans la transition énergétique qui impliquent l'ajout d'oxygène à de petites molécules organiques (contenant du carbone) telles que l'éthanol, le méthanol et l'acide formique. L'hypothèse conventionnelle est que le réactif et l'oxygène réagissent chimiquement pour former le produit plus l'eau. Et un catalyseur solide, souvent une combinaison de métaux, est présent pour fournir des sites sur lesquels le réactif et l'oxygène peuvent interagir.
Mais Surendranath a proposé une vision différente de ce qui se passe. Dans la configuration habituelle, deux catalyseurs, chacun composé de nombreuses nanoparticules, sont montés sur un substrat de carbone conducteur et immergés dans l'eau. Dans cet arrangement, les électrons chargés négativement peuvent circuler facilement à travers le carbone, tandis que les protons chargés positivement peuvent circuler facilement à travers l'eau.
L'hypothèse de Surendranath était que la conversion du réactif en produit progresse au moyen de deux "demi-réactions" séparées sur les deux catalyseurs. Sur un catalyseur, le réactif se transforme en un produit, dans le processus envoyant des électrons dans le substrat de carbone et des protons dans l'eau. Ces électrons et protons sont captés par l'autre catalyseur, où ils entraînent la conversion de l'oxygène en eau. Ainsi, au lieu d'une seule réaction, deux demi-réactions distinctes mais coordonnées réalisent ensemble la conversion nette du réactif en produit.
En conséquence, la réaction globale n'implique en fait aucune production ou consommation nette d'électrons. Il s'agit d'une réaction "thermique" standard résultant de l'énergie dans les molécules et peut-être d'un peu de chaleur ajoutée. L'approche conventionnelle de conception d'un catalyseur pour une telle réaction se concentrerait sur l'augmentation de la vitesse de conversion de ce réactif en produit. Et le meilleur catalyseur pour ce type de réaction pourrait s'avérer être, par exemple, l'or, le palladium ou un autre métal précieux coûteux.
Cependant, si cette réaction implique en fait deux demi-réactions, comme l'a proposé Surendranath, il y a un flux de charge électrique (les électrons et les protons) entre elles. Ainsi, Surendranath et d'autres dans le domaine pourraient à la place utiliser des techniques d'électrochimie pour concevoir non pas un seul catalyseur pour la réaction globale, mais plutôt deux catalyseurs séparés, un pour accélérer une demi-réaction et un pour accélérer l'autre demi-réaction. "Cela signifie que nous n'avons pas à concevoir un seul catalyseur pour faire tout le gros du travail d'accélération de l'ensemble de la réaction", explique Surendranath. "Nous pourrions être en mesure d'associer deux catalyseurs peu coûteux et abondants en terre, dont chacun effectue bien la moitié de la réaction, et ensemble, ils effectuent la transformation globale rapidement et efficacement."
Mais il y a une autre considération :les électrons peuvent circuler à travers l'ensemble du catalyseur composite, qui englobe la ou les particules de catalyseur et le substrat de carbone. Pour que la conversion chimique se produise aussi rapidement que possible, la vitesse à laquelle les électrons sont introduits dans le catalyseur composite doit correspondre exactement à la vitesse à laquelle ils sont retirés. En se concentrant uniquement sur les électrons, si la conversion de la réaction en produit sur le premier catalyseur envoie le même nombre d'électrons par seconde dans le "bain d'électrons" du catalyseur composite que la conversion de l'oxygène en eau sur le second catalyseur prend dehors, les deux demi-réactions seront équilibrées et le flux d'électrons - et la vitesse de la réaction combinée - sera rapide. L'astuce consiste à trouver de bons catalyseurs pour chacune des demi-réactions qui correspondent parfaitement en termes d'électrons entrants et sortants.
"Un bon catalyseur ou une paire de catalyseurs peut maintenir un potentiel électrique - essentiellement une tension - auquel les deux demi-réactions sont rapides et équilibrées", explique Jaeyune Ryu Ph.D. '21, ancien membre du laboratoire Surendranath et auteur principal de l'étude; Ryu est maintenant postdoctorant à l'Université de Harvard. "Les vitesses des réactions sont égales et la tension dans le catalyseur composite ne changera pas pendant la réaction thermique globale."
S'appuyer sur l'électrochimie
Sur la base de leur nouvelle compréhension, Surendranath, Ryu et leurs collègues se sont tournés vers des techniques d'électrochimie pour identifier un bon catalyseur pour chaque demi-réaction qui s'associerait également pour bien fonctionner ensemble. Leur cadre analytique pour guider le développement de catalyseurs pour les systèmes qui combinent deux demi-réactions est basé sur une théorie qui a été utilisée pour comprendre la corrosion pendant près de 100 ans, mais qui a rarement été appliquée pour comprendre ou concevoir des catalyseurs pour des réactions impliquant de petites molécules importantes pour la transition énergétique.
La clé de leur travail est un potentiostat, un type de voltmètre qui peut soit mesurer passivement la tension d'un système, soit modifier activement la tension pour provoquer une réaction. Dans leurs expériences, Surendranath et son équipe utilisent le potentiostat pour mesurer la tension du catalyseur en temps réel, en surveillant son évolution de milliseconde en milliseconde. Ils corrèlent ensuite ces mesures de tension avec des mesures simultanées mais séparées du taux global de catalyse pour comprendre la voie de réaction.
Pour leur étude de la conversion de petites molécules liées à l'énergie, ils ont d'abord testé une série de catalyseurs pour en trouver de bons pour chaque demi-réaction - un pour convertir le réactif en produit, produisant des électrons et des protons, et un autre pour convertir l'oxygène. à l'eau, consommant des électrons et des protons. Dans chaque cas, un candidat prometteur produirait une réaction rapide, c'est-à-dire un flux rapide d'électrons et de protons entrant ou sortant.
Pour aider à identifier un catalyseur efficace pour effectuer la première demi-réaction, les chercheurs ont utilisé leur potentiostat pour entrer des tensions soigneusement contrôlées et ont mesuré le courant résultant qui traversait le catalyseur. Un bon catalyseur générera beaucoup de courant pour peu de tension appliquée ; un mauvais catalyseur nécessitera une tension appliquée élevée pour obtenir la même quantité de courant. L'équipe a ensuite suivi la même procédure pour identifier un bon catalyseur pour la seconde demi-réaction.
Pour accélérer la réaction globale, les chercheurs devaient trouver deux catalyseurs qui correspondaient bien - où la quantité de courant à une tension appliquée donnée était élevée pour chacun d'eux, garantissant que l'un produisait un flux rapide d'électrons et de protons, l'autre les consommaient au même rythme.
Pour tester des paires prometteuses, les chercheurs ont utilisé le potentiostat pour mesurer la tension du catalyseur composite pendant la catalyse nette, sans changer la tension comme auparavant, mais maintenant en la mesurant simplement à partir de minuscules échantillons. Dans chaque test, la tension se stabilisera naturellement à un certain niveau, et l'objectif est que cela se produise lorsque le taux des deux réactions est élevé.
Valider leur hypothèse et regarder vers l'avenir
En testant les deux demi-réactions, les chercheurs ont pu mesurer comment la vitesse de réaction de chacune variait avec les changements de tension appliquée. À partir de ces mesures, ils pouvaient prédire la tension à laquelle la réaction complète se déroulerait le plus rapidement. Les mesures de la réaction complète correspondaient à leurs prédictions, soutenant leur hypothèse.
La nouvelle approche de l'équipe consistant à utiliser des techniques d'électrochimie pour examiner des réactions considérées comme strictement de nature thermique fournit de nouvelles informations sur les étapes détaillées par lesquelles ces réactions se produisent et donc sur la manière de concevoir des catalyseurs pour les accélérer. "Nous pouvons maintenant utiliser une stratégie de division pour mieux régner", déclare Ryu. "Nous savons que la réaction thermique nette dans notre étude se produit à travers deux demi-réactions" cachées "mais couplées, nous pouvons donc viser à optimiser une demi-réaction à la fois" - éventuellement en utilisant des matériaux catalyseurs à faible coût pour l'une ou les deux.
Surendranath ajoute :« L'une des choses qui nous enthousiasment dans cette étude est que le résultat n'est pas définitif en soi. Il a vraiment semé un tout nouveau domaine d'intérêt dans notre programme de recherche, y compris de nouvelles façons de concevoir des catalyseurs. pour la production et la transformation de carburants et de produits chimiques renouvelables."
Cette histoire est republiée avec l'aimable autorisation de MIT News (web.mit.edu/newsoffice/), un site populaire qui couvre l'actualité de la recherche, de l'innovation et de l'enseignement du MIT. Un catalyseur bon marché et respectueux de l'environnement ouvre de nouvelles possibilités pour les molécules organiques construites à partir de pyruvate