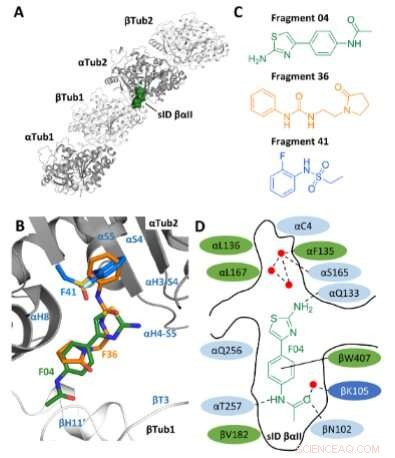
Sélection de fragments. A) Localisation du site sID βαII (représentation en volume) à l'interface interdimère βTub1-αTub2 du T2 Complexe R-TTL. Pour simplifier, les chaînes RB3 et TTL ne sont pas représentées. Les deux monomères α- et deux β-tubuline dans le T2 Les complexes R-TTL sont représentés respectivement en ruban gris et blanc. B) Superposition des poses de liaison F04, F36 et F41 (ID PDB 5S4O, 5S5K et 5S5P, respectivement). Les éléments de structure secondaire de la tubuline sont marqués en bleu. Les atomes de carbone sont colorés en vert pour F04, en orange pour le fragment F36 et en bleu clair pour le fragment F41. Les atomes d'azote sont colorés en bleu, les atomes d'oxygène en rouge, les atomes de soufre en jaune et les atomes de fluor en vert clair. C) Structures chimiques des fragments F04, F36 et F41. D) Représentation schématique de F04 lié au site sID βαII. Les résidus formant le site de liaison sont représentés en vert pour les hydrophobes, en bleu clair pour les polaires et en bleu foncé pour les résidus chargés. Les résidus en interaction αL242 et αL252 ne sont pas représentés car ils sont situés sous le ligand. Les liaisons hydrogène sont indiquées par des interactions en pointillés et π-empilement avec des lignes noires pleines. Les points rouges représentent les molécules d'eau cristallographiques. Crédit :Angewandte Chemie International Edition (2022). DOI :10.1002/anie.202204052
Des chercheurs de l'Institut Paul Scherrer PSI et de l'Institut italien de technologie IIT ont mis au point une nouvelle substance qui désactive une protéine du squelette cellulaire, entraînant la mort cellulaire. De cette manière, des substances de ce type peuvent empêcher, par exemple, la croissance de tumeurs. Pour ce faire, les chercheurs ont combiné une méthode biologique structurale avec la conception informatique d'agents actifs. L'étude a été publiée dans la revue Angewandte Chemie International Edition .
Le squelette cellulaire, également appelé cytosquelette, imprègne toutes nos cellules en tant que réseau dynamique de structures protéiques filiformes. Il donne aux cellules leur forme, facilite le transport des protéines et des composants cellulaires plus gros et joue un rôle crucial dans la division cellulaire. Le bloc de construction central est la protéine tubuline. Il s'organise en structures en forme de tube, les filaments de microtubules.
Les agents actifs qui se fixent au squelette cellulaire sont parmi les médicaments les plus efficaces contre le cancer. Ils bloquent la tubuline et empêchent ainsi la division cellulaire dans les tumeurs. Des chercheurs du PSI, en collaboration avec l'Institut italien de technologie de Gênes, ont mis au point une autre substance puissante qui désactive la tubuline. Ils l'ont surnommé "Todalam".
"Todalam empêche la tubuline de se disposer sous la forme de filaments de microtubules", explique le premier auteur Tobias Mühlethaler, qui a co-conçu et étudié la substance dans le cadre de sa recherche doctorale au PSI. "La protéine reste comme si elle était congelée dans une structure qui ne rentre pas dans les microtubules."
Conçu de manière rationnelle
Il existe généralement deux approches différentes pour développer de nouveaux médicaments :les chercheurs peuvent tester un nombre énorme de molécules pour repérer celles qui semblent prometteuses, ou ils peuvent concevoir spécifiquement des molécules chimiques qui obtiennent l'effet souhaité. Les chercheurs du PSI et de l'IIT ont choisi la deuxième voie, souvent plus difficile.
Ce faisant, ils ont pu s'appuyer sur leurs propres travaux de base, des recherches dans lesquelles ils avaient déjà localisé des endroits dans la tubuline où les molécules peuvent particulièrement bien s'ancrer. Ce sont les soi-disant poches de liaison, dont ils ont trouvé 27. De plus, les chercheurs ont identifié 56 fragments qui se lient à ces sites. Ce travail avait également été publié précédemment dans Angewandte Chemie International Edition .
Dans l'étude actuelle basée sur ces travaux antérieurs, les chercheurs ont initialement sélectionné une poche de liaison nouvellement découverte sur la tubuline. Ils ont utilisé la conception informatique pour combiner les structures de trois fragments moléculaires, qui s'ancrent préférentiellement à ce stade, en un seul composé chimique, puis ils l'ont synthétisé en laboratoire. "En combinant les trois fragments en une seule molécule, nous espérions renforcer l'effet, car la nouvelle molécule remplit mieux la poche de liaison", explique Michel Steinmetz, responsable du Laboratoire de recherche biomoléculaire au PSI.
À l'aide de mesures à la Swiss Light Source SLS, les chercheurs ont vérifié si la molécule s'insérait réellement dans la poche de liaison. En deux cycles supplémentaires, ils ont amélioré la substance jusqu'à leur arrivée à Todalam. "Avec une chimie relativement simple, nous avons réussi à obtenir un composé puissant", déclare fièrement Andrea Prota, un scientifique du groupe Steinmetz qui a collaboré étroitement avec Mühlethaler.
Structure chimique simple
Dans des cultures cellulaires, les chercheurs ont démontré que le Todalam tue les cellules. Pas étonnant, puisque la tubuline est essentielle à la vie. "Plus une substance se lie à un site critique de la tubuline, plus elle est toxique pour les cellules", explique Steinmetz. Cela fait de Todalam un point de départ prometteur pour le développement d'un médicament.
Les inhibiteurs du cytosquelette actuellement utilisés en clinique sont des substances naturelles avec de grandes structures complexes et sont donc difficiles à synthétiser. Le composé nouvellement développé Todalam, d'autre part, peut être produit dans une synthèse chimique simple en laboratoire. "Cela signifie également que le composé pourrait être produit en grandes quantités relativement facilement", souligne Steinmetz. Le cytosquelette cellulaire comme cible de nouveaux actifs